题目内容
16.AgCl(s)?Ag++Cl-,平衡时[Ag+][Cl-]=Ksp,过量氯化银分别投入①100mL水 ②24mL0.1mol•L-1NaCl ③10mL 0.1mol•L-1MgCl2 ④30mL 0.1mol•L-1AgNO3溶液中,溶液中[Ag+]从大到小顺序( )| A. | ③①②④ | B. | ④①②③ | C. | ①②③④ | D. | ④③②① |
分析 从平衡移动的角度分析,将足量氯化银分别放入相同体积的溶液中,依据温度不变Ksp=c(Ag+)•c(Cl-)为定值,Cl-浓度越大,则Ag+的浓度越小,如放在银盐溶液中,则c(Ag+)最大,以此解答该题.
解答 解:先根据加入c(Cl-)大小比较,加入c(Cl-)越小,则c(Ag+)越大,
①100mL蒸馏水中,c(Cl-)=0,
②24mL 0.1mol•L-1NaCl,c(Cl-)=0.1mol•L-1,
③10mL 0.1mol•L-1MgCl2 中,c(Cl-)=0.2mol•L-1,
所以Cl-浓度:③>②>①,依据Ksp=c(Ag+)•c(Cl-)为定值,银离子浓度由大到小的顺序是:①②③,
而④加入的是银离子,所以30mL 0.1mol•L-1AgNO3溶液中c(Ag+)=0.1mol•L-1,所以④中c(Ag+)最大;
银离子浓度由大到小的顺序是:④①②③,
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,题目侧重于浓度对平衡移动的影响,难度不大,注意把握影响溶解平衡移动的因素.

练习册系列答案
相关题目
7.某离子化合物的晶体中,最小重复单元及其八分之一结构单元如图所示,具有该晶体结构的化合物可能是( )


| A. | CaF2 | B. | CO2 | C. | NaCl | D. | CsCl |
4.下列可构成原电池装置的是( )
| A. |  | B. |  | C. |  | D. |  |
11.下列各组离子在水溶液中能够大量共存的是( )
| A. | Ba2+、SO42-、SO32- | B. | Na+、C1-、OH- | ||
| C. | NH4+、OH -、SO42- | D. | H+、CO32-、NO3- |
1.下列物质沸点的比较,错误的是( )
| A. | 丙烷>乙烷 | B. | 丁烷>乙醇 | C. | 苯酚>苯 | D. | 1-氯丙烷>丙烷 |
8.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 1molSiO2晶体内含有2NA个Si-O键 | |
| B. | 在0.1mol熔融KHSO4中,含有0.1NA个SO42- | |
| C. | 在0.5L 1mol•L-1的盐酸中所含粒子总数为NA | |
| D. | 1molSi晶体内含有2NA个Si-Si键 |
5.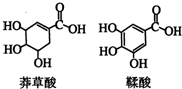 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )
 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )| A. | 两种酸都能与溴水反应 | |
| B. | 两种酸遇三氯化铁溶液都显色 | |
| C. | 鞣酸分子与莽草酸分子相比多了两个碳碳双键 | |
| D. | 等物质的量的两种酸与足量金属钠反应产生氢气的量不相同 |
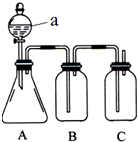 某同学设计了如图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱.供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液
某同学设计了如图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱.供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液 如图是某同学设计的放热反应的观察装置,其实验操作步骤如下:①按图所示将实验装置连接好,②在U形管内加入少量红墨水,打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞,③在盛有1g氧化钙的小试管里滴入2mL左右的蒸馏水,观察现象.
如图是某同学设计的放热反应的观察装置,其实验操作步骤如下:①按图所示将实验装置连接好,②在U形管内加入少量红墨水,打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞,③在盛有1g氧化钙的小试管里滴入2mL左右的蒸馏水,观察现象.