题目内容
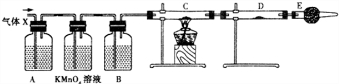
19.将6.4g铜与一定浓度的浓硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为1.12L,回答下列问题:①写出铜与浓硝酸反应生成NO2气体的离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
②参加反应的硝酸的物质的量是:0.25mol.
分析 ①Cu与浓硝酸反应生成硝酸铜、NO2与水;
②根据守恒,硝酸的物质的量为:2n(Cu)+n(NO)+n(NO2).
解答 解:①Cu与浓硝酸反应生成硝酸铜、NO与水,反应离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
②根据守恒,硝酸的物质的量为:2n(Cu)+n(NO)+n(NO2)=$\frac{6.4g}{64g/mol}$×2+$\frac{1.12L}{22.4L/mol}$=0.2+0.05=0.25mol,故答案为:0.25.
点评 本题考查离子方程式的书写和有关计算,难度不大,注意利用守恒思想进行解答.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
9.下列说法正确的是( )
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 水汽化需要吸收能量,所以水汽化属于吸热反应 | |
| C. | 所有的化合反应都是放热反应 | |
| D. | 1 mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 |
4.用下列实验装置和方法进行相应的实验,不能达到实验目的是( )


| A. | 用图1装置和方法测定一定时间内生成H2的反应速率 | |
| B. | 用图2装置和方法进行C02喷泉实验 | |
| C. | 用图3装装置和方法除去氯气中的氯化氢 | |
| D. | 用图4装置和方法比较Na2C03与NaHC03热稳定性 |
6.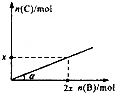 某容积可变的密闭容器中盛有足量的A,通人气体B,发生反应:A(s)+3B(g)?2C(g)+D(g);△H<0,在一定温度和压强下达到平衡.若平衡时C的物质的量与加入B的物质的量的变化关系如图所示.则下列说法中正确的是( )
某容积可变的密闭容器中盛有足量的A,通人气体B,发生反应:A(s)+3B(g)?2C(g)+D(g);△H<0,在一定温度和压强下达到平衡.若平衡时C的物质的量与加入B的物质的量的变化关系如图所示.则下列说法中正确的是( )
 某容积可变的密闭容器中盛有足量的A,通人气体B,发生反应:A(s)+3B(g)?2C(g)+D(g);△H<0,在一定温度和压强下达到平衡.若平衡时C的物质的量与加入B的物质的量的变化关系如图所示.则下列说法中正确的是( )
某容积可变的密闭容器中盛有足量的A,通人气体B,发生反应:A(s)+3B(g)?2C(g)+D(g);△H<0,在一定温度和压强下达到平衡.若平衡时C的物质的量与加入B的物质的量的变化关系如图所示.则下列说法中正确的是( )| A. | 若保持压强不变,降低温度时,图中角度a将变小 | |
| B. | 若增大压强,缩小容器的体积,平衡向正反应方向移动 | |
| C. | 若保持压强不变,再通入B,则再次达到平衡时正、逆反应速率均增大 | |
| D. | 平衡时B、C的物质的量之比为1:2 |
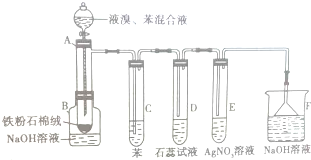 如图为探讨苯和液溴反应改进的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一个小孔,并塞好石棉绒,实验时先加少量铁粉于石棉绒上,填写下列空白:
如图为探讨苯和液溴反应改进的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一个小孔,并塞好石棉绒,实验时先加少量铁粉于石棉绒上,填写下列空白: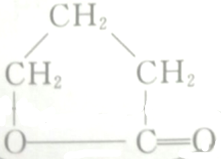 的各步反应方程式:
的各步反应方程式: