题目内容
9.如图是四种短周期元素在元素周期表中的相对位置,其中X和Y原子的质子数之和为(10n+m)、Z和W原子的核外电子数之和为(10m+n)(m、n均为正整数).下列说法正确的是( )| X | Y | |
| Z | W |
| A. | X、Y、W三种元素的气态氢化物中,X的气态氢化物的水溶液碱性最强 | |
| B. | XW2的电子式为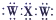 | |
| C. | 实验室制备YO2和WO2的发生装置都可用 | |
| D. | W和Y 的最高价氧化物对应的水化物的稀溶液溶解铁,表现出的性质相同 |
分析 由图中四种短周期元素在元素周期表中的相对位置,可知X、Y为第二周期元素,其中X和Y原子的质子数之和为(10n+m)≤7+8=15,则n=1符合,Z和W原子的核外电子数之和为(10m+n)≤16+17=35,即10m≤3.4,则m=3符合题意,即X和Y原子的质子数之和为13,Z和W原子的核外电子数之和为31,Y、Z为同主族元素,则X为C,Y为N,Z为P,W为S符合质子数、核外电子数及位置关系,然后结合元素化合物知识来解答.
解答 解:由图中四种短周期元素在元素周期表中的相对位置,可知X、Y为第二周期元素,其中X和Y原子的质子数之和为(10n+m)≤7+8=15,则n=1符合,Z和W原子的核外电子数之和为(10m+n)≤16+17=35,即10m≤3.4,则m=3符合题意,即X和Y原子的质子数之和为13,Z和W原子的核外电子数之和为31,Y、Z为同主族元素,则X为C,Y为N,Z为P,W为S,
A.X、Y、W三种元素的气态氢化物中,X的气态氢化物甲烷不溶于水,Y的氢化物为氨气,其水溶液碱性最强,W的氢化物为硫化氢,其水溶液显酸性,故A错误;
B.XW2的电子式为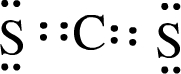 ,X、W之间为两对共用电子对,故B错误;
,X、W之间为两对共用电子对,故B错误;
C.实验室制备NO2(Cu和浓硝酸反应)和SO2(硫酸与亚硫酸盐)的反应均为固体与液体反应,且不需要加热,则发生装置都可用 ,故C正确;
,故C正确;
D.W的最高价氧化物对应的水化物为硫酸,Y的最高价氧化物对应的水化物为硝酸,稀硫酸与Fe反应生成硫酸亚铁和氢气,稀硝酸与Fe反应生成硝酸盐、NO和水,硝酸体现强氧化性,性质不完全相同,故D错误;
故选C.
点评 本题考查位置、结构与性质的关系,为高频考点,把握质子数=核外电子数及元素的位置关系推断元素为解答的关键,侧重分析与推断能力的考查,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 1:1 | B. | 10:1 | C. | <10:1 | D. | >10:1 |
| 元素 | 相关信息 |
| X | X一种核素在考古时常用来坚定一些文物的年代 |
| Y | Y基态原子的s轨道电子与P轨道电子数相等 |
| Z | Z是所在周期的单核离子中半径最小 |
| W | W的单质被誉为“信息革命的催化剂”常用做半导体材料 |
| T | T有多种氧化物,其中一种纯净的氧化物可用来作录音磁带和 电讯器材的原材料 |
(2)T2+的电子排布式为1s22s22p63s23p63d6;T的单质在高温下与Y的氢化物反应,其化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;工业上用W的氧化物与X的单质高温下反应制得W单质的粗产品,其化学反应方程式为SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)两种氢化物X2H2和H2Y2中沸点较高的是H2O2,两者沸点相差很大的原因是H2O2分子之间存在氢键,而C2H2分子之间为范德华力.
(4)在25℃、101kPa下,已知W稳定的气态氢化物在Y的气态单质中完全燃烧,恢复至原来状态,平均每消耗4gW稳定的气态氢化物放热190.0KJ,则该反应的热化学方程式SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520kJ/mol.
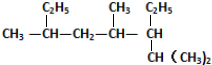 的主链碳原子数是( )
的主链碳原子数是( )| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
| A. | H+H→H-H | B. | H-Cl→H+Cl | ||
| C. | Mg+2HCl=MgCl2+H2↑ | D. | H2SO4+2NaOH=Na2SO4+2H2O |
| A. | 在含有FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| B. | 在含有Ag+、Fe3+、Cu2+ 的溶液中加入锌粉:Ag+、Cu2+、Fe3+ | |
| C. | 在含有NH4 +、H+、Al3+ 的溶液中,逐滴加入NaOH溶液:H+、Al3+、NH4 +、Al(OH)3 | |
| D. | 在含有Ca(OH)2、NaOH的溶液中,缓慢通入CO2:NaOH、Ca(OH)2、Na2CO3、CaCO3 |
| A. | X的原子序数比Y的小 | B. | X原子的最外层电子数比Y的大 | ||
| C. | X和Y原子的电子层数相等 | D. | X的原子半径比Y的大 |
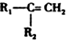 $\stackrel{HBr/过氧化物}{→}$
$\stackrel{HBr/过氧化物}{→}$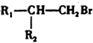 ②
②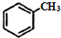 $\stackrel{KMnO/H-}{→}$
$\stackrel{KMnO/H-}{→}$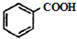
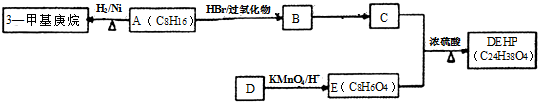
 ;反应类型:取代反应;
;反应类型:取代反应;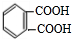 ;DEHP的结构简式是
;DEHP的结构简式是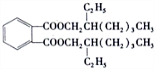 ;
;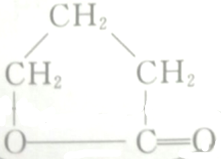 的各步反应方程式:
的各步反应方程式: