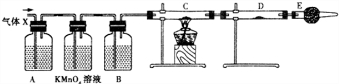
题目内容
3.化合物A是一种热稳定性较差的无水的弱酸钠盐,用如下方法对其进行分析:将A与惰性填料混合均匀制成样品,加热至400℃,记录含A量不同的样品的质量损失(%),结果如表:利用上述信息,有关说法正确的是( )| 样品中A的质量分数/% | 20 | 50 | 70 | 90 |
| 样品的质量损失/% | 7.4 | 18.5 | 25.9 | 33.3 |
| A. | 化合物A的摩尔质量为104g•mol-1 | |
| B. | 样品A的质量分数为55%,加热至400℃样品质量损失21.35% | |
| C. | 样品A加热后的气体能使品红褪色 | |
| D. | 16.8g化合物A加热至质量不变化后,剩余固体质量为10.6g |
分析 根据表中数据可知:$\frac{20}{7.4}=\frac{50}{18.5}=\frac{70}{25.9}=\frac{90}{33.3}$,即:样品的质量损失与A的质量分数成正比,则当样品中A的质量分数为100%时,样品的损失质量为:7.4%×$\frac{100%}{20%}$=37%;
样品是热稳定性较差的无水弱酸钠盐,在常见的弱酸盐中,首先考虑碳酸氢钠,其分解反应为:2NaHCO3=Na2CO3+H2O↑+CO2↑,该反应质量损失分数为:$\frac{44+18}{84×2}$×100%≈37%,与上述外推所得数据吻合,则该化合物A为NaHCO3,据此对各选项进行判断.
解答 解:根据表中数据可知:$\frac{20}{7.4}=\frac{50}{18.5}=\frac{70}{25.9}=\frac{90}{33.3}$,即:样品的质量损失与A的质量分数成正比,则当样品中A的质量分数为100%时,样品的损失质量为:7.4%×$\frac{100%}{20%}$=37%,
样品是热稳定性较差的无水弱酸钠盐,在常见的弱酸盐中,首先考虑碳酸氢钠,其分解反应为:2NaHCO3=Na2CO3+H2O↑+CO2↑,该反应质量损失分数为$\frac{44+18}{84×2}$×100%≈37%,与上述外推所得数据吻合,则该化合物A为NaHCO3,
A.根据分析可知,A的摩尔质量为84g/mol,故A错误;
B.样品A的质量分数为55%,加热至400℃样品质量损失为:7.4%×$\frac{55%}{20%}$=20.35%,故B错误;
C.碳酸氢钠加热分解生成二氧化碳气体,二氧化碳气体不能使品红溶液褪色,故C错误;
D.根据反应方程式2NaHCO3=Na2CO3+H2O↑+CO2↑可知,16.8g化合物A加热至质量不变化后,剩余固体质量为:16.8g×$\frac{106}{168}$=10.6g,故D正确;
故选D.
点评 本题考查了质量分数的计算,题目难度中等,正确推断A的化学式为解答关键,试题侧重考查学生的分析、理解及归纳能力,注意掌握质量分数的概念及计算方法.

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案| A. | 在含有FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| B. | 在含有Ag+、Fe3+、Cu2+ 的溶液中加入锌粉:Ag+、Cu2+、Fe3+ | |
| C. | 在含有NH4 +、H+、Al3+ 的溶液中,逐滴加入NaOH溶液:H+、Al3+、NH4 +、Al(OH)3 | |
| D. | 在含有Ca(OH)2、NaOH的溶液中,缓慢通入CO2:NaOH、Ca(OH)2、Na2CO3、CaCO3 |
| A. | 用电子式表示氢溴酸的形成过程为: | |
| B. | 海水中Br-的电子式为: | |
| C. | 海水中通入氯气时发生反应的离子方程式为:2Br-+Cl2=Br2+2Cl- | |
| D. | Cl-的结构示意图为: |
| A. | 青苹果中只含淀粉,不含糖类物质 | |
| B. | 熟的苹果中只含糖类,不含淀粉 | |
| C. | 苹果从青转熟时,淀粉水解生成单糖 | |
| D. | 苹果从青转熟时,单糖缩聚成淀粉 |
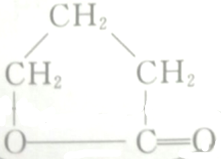 的各步反应方程式:
的各步反应方程式: