题目内容
4.下列是某同学对NaHSO4的物质类型进行的分析,其中不正确的是( )| A. | 根据元素组成可判断是化合物 | |
| B. | 因它电离会生成钠离子又符合盐的组成,故可属于钠盐 | |
| C. | 因它电离会生成硫酸根离子又符合盐的组成,故可属于硫酸盐 | |
| D. | NaHSO4溶于水可电离出氢离子故可以称为酸 |
分析 A.化合物是由不同种元素组成的纯净物;
B.盐是金属阳离子和酸根阴离子构成的化合物,钾盐是指盐含有钾离子的盐;
C.硫酸盐指金属离子(铵根)和硫酸酸根离子构成的盐;
D.酸电离时生成的阳离子全部是氢离子(H+).
解答 解:A.NaHSO4是由钠元素、氢元素、硫元素、氧元素组成的化合物,故A正确;
B.是由阴离子HSO4-和阳离子Na+相互作用而形成的离子化合物,所以NaHSO4是钠盐,故B正确;
C.NaHSO4电离会生成硫酸根离子、氢离子和Na+,所以可以称为硫酸盐,故C正确;
D.NaHSO4为强电解质,电离方程式为NaHSO4═Na++H++SO42-,阳离子有氢离子和钠离子,不符合酸的定义,它是酸式盐,故D错误;
故选D.
点评 本题主要考查酸、碱、盐、氧化物的概念及其相互联系等知识,注意物质KHSO4的电离是解题的关键,题目难度不大.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
16.向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示下列说法不正确的是( ) 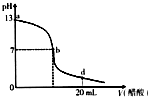

| A. | 该氢氧化钠溶液的物质的量浓度为0.1 mol/L | |
| B. | 在b点,c(Na+)=c(CH3COO-) | |
| C. | 在d点,溶液中所有离子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点 |
14.在化学反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,当有1.5摩铜被氧化时( )
| A. | 有4mol硝酸被还原 | B. | 有1mol硝酸被还原 | ||
| C. | 转移6mol电子 | D. | 生成NO 22.4L |


 的系统命名:3,4-二甲基已烷;
的系统命名:3,4-二甲基已烷; 的键线式:
的键线式: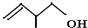 .
.