题目内容
13.常温下,pH=13的Ba(OH)2溶液amL与pH=1的H2SO4溶液bmL混合(混合后溶液体积变化忽略不计).若所得混合溶液pH=12,求a:b.分析 常温下,pH=13的Ba(OH)2溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-13}}$mol/L=0.1mol/L,pH=1的H2SO4溶液中c(H+)=0.1mol/L,二者混合溶液pH=12>7,溶液呈碱性,则混合溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L=0.01mol/L=$\frac{c(O{H}^{-})V(碱)-c({H}^{+})V(酸)}{V(酸)+V(碱)}$,据此计算a:b.
解答 解:常温下,pH=13的Ba(OH)2溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-13}}$mol/L=0.1mol/L,pH=1的H2SO4溶液中c(H+)=0.1mol/L,二者混合溶液pH=12>7,溶液呈碱性,则混合溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L=0.01mol/L=$\frac{c(O{H}^{-})V(碱)-c({H}^{+})V(酸)}{V(酸)+V(碱)}$=$\frac{0.1mol/L×amL-0.1mol/L×bmL}{(a+b)mL}$,则a:b=11:9,
答:反应前酸碱体积a:b=11:9.
点评 本题考查酸碱混合溶液定性判断,侧重考查计算能力,正确计算溶液中c(OH-)是解本题关键,常见混合溶液pH的有关计算有:酸酸混合、碱碱混合、酸碱混合,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.胶体区别于其它分散系的实质是( )
| A. | 胶体可发生丁达尔效应 | B. | 胶体粒子能够发生布朗运动 | ||
| C. | 胶体能透过滤纸但不能透过滤纸 | D. | 胶体粒子直径在1nm-100nm之间 |
4.一次性筷子的大量使用加速了对森林的破坏.森林是二氧化碳的转换器,是降雨的发生器,是洪涝的控制器,是生物多样性的保护区,此功能绝不是生产一次性筷子所得的效益能代替的.二氧化碳的大量排放可能引起的环境问题( )
| A. | 臭氧层空洞 | B. | 光化学烟雾 | C. | 酸雨 | D. | 温室效应 |
1.下表是某食品包装袋上的说明.
(1)其中属于营养强化剂的有(填一种,下同)维生素C,属于防腐剂的有山梨酸钾.
(2)下列关于食品添加剂的说法中,正确的是c.
a.为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠
b.为了使婴儿食品的色泽诱人,可以加少量着色剂
c.为了预防地方性甲状腺肿,可以在食盐中加适量碘酸钾
(3)医学科学家们研究发现,食物中除糖类、脂肪、蛋白质外,还有一类物质与人体健康有着密切关系,它们就是维生素.下列维生素中,属于脂溶性维生素的是a(填序号,下同),可用于防治坏血病的是d.
a.维生素A b.维生素B1 c.维生素B2 d.维生素C.
| 品 名 | 浓缩菠萝汁 |
| 配 料 | 水、浓缩菠萝汁、蔗糖、柠檬酸、黄原胶、甜蜜素、维生素C、菠萝香精、柠檬黄、日落黄、山梨酸钾等 |
| 果汁含量 | ≥80% |
| 生产日期 | 标于包装袋封口上 |
(2)下列关于食品添加剂的说法中,正确的是c.
a.为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠
b.为了使婴儿食品的色泽诱人,可以加少量着色剂
c.为了预防地方性甲状腺肿,可以在食盐中加适量碘酸钾
(3)医学科学家们研究发现,食物中除糖类、脂肪、蛋白质外,还有一类物质与人体健康有着密切关系,它们就是维生素.下列维生素中,属于脂溶性维生素的是a(填序号,下同),可用于防治坏血病的是d.
a.维生素A b.维生素B1 c.维生素B2 d.维生素C.
8.在pH=1的溶液中,可以大量共存的离子组是( )
| A. | Na+、K+、S2-、Cl- | B. | K+、Na+、SO42-、NO3- | ||
| C. | K+、Na+、SiO32-、NO3- | D. | Ba2+、Mg2+、SO42-、Cl- |
5.一定条件下反应2AB(g)?A2(g)+B2(g)达到平衡状态的标志是( )
| A. | 单位时间内生成nmolA2,同时消耗2n molAB | |
| B. | 容器内压强不随时间而变化 | |
| C. | AB的消耗速率等于A2的消耗速率 | |
| D. | 容器中各组分的体积分数不随时间变化 |
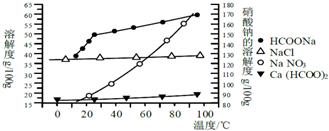
3.某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算),现提供的试剂有:
a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
请补充完整由碳酸钙制备甲酸钙的实验步骤
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2.用稍过量硝酸溶解碳酸钙样品.
步骤3.用石灰水调整溶液pH=5.
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩(蒸发结晶)、趁热过滤、洗涤干燥得甲酸钙晶体.
a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2.用稍过量硝酸溶解碳酸钙样品.
步骤3.用石灰水调整溶液pH=5.
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩(蒸发结晶)、趁热过滤、洗涤干燥得甲酸钙晶体.

4.下列是某同学对NaHSO4的物质类型进行的分析,其中不正确的是( )
| A. | 根据元素组成可判断是化合物 | |
| B. | 因它电离会生成钠离子又符合盐的组成,故可属于钠盐 | |
| C. | 因它电离会生成硫酸根离子又符合盐的组成,故可属于硫酸盐 | |
| D. | NaHSO4溶于水可电离出氢离子故可以称为酸 |