题目内容
【题目】按要求回答下列问题:
(1)以下物质中:①酒精 ②熔化的KNO3 ③CaCO3 ④氢氧化钠溶液 ⑤铜 ⑥SO2
其中属于电解质的是_________(填编号,下同),属于非电解质的是__________。
(2)画出氟离子的结构示意图________________;用于制造光导纤维的物质的化学式_______。
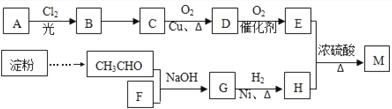
(3)已知加热条件下氯气和NaOH溶液可发生以下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O
a.标出上面反应电子转移的方向和数目_______。
b.以上反应中氧化剂与还原剂的物质的量之比为_________。
c.若有21.3g Cl2参加反应,转移的电子数为__________。
【答案】②③ ①⑥  SiO2
SiO2  5:1 0.5NA
5:1 0.5NA
【解析】
(1)溶于水或在熔融状态下能够导电的化合物是电解质,溶于水和在熔融状态下均不能导电的化合物是非电解质,据此判断;
(2)根据氟的原子序数是9分析解答;根据二氧化硅用于制造光导纤维分析解答;
(3)反应中氯元素化合价从0价部分升高到+5价,部分降低到-1价,据此解答。
(1)①酒精不导电,溶于水也不导电,是非电解质;
②熔化的KNO3导电,是电解质;
③CaCO3在熔融状态下能够导电,是电解质;
④氢氧化钠溶液属于混合物,不是电解质也不是非电解质;
⑤铜是金属单质,不是电解质也不是非电解质;
⑥SO2不能电离出离子,是非电解质。
则其中属于电解质的是②③,属于非电解质的是①⑥。
(2)氟的原子序数是9,则氟离子的结构示意图为 ;用于制造光导纤维的物质是二氧化硅,化学式为SiO2。
;用于制造光导纤维的物质是二氧化硅,化学式为SiO2。
(3)a.反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O中氯元素化合价部分从0价降低到-1价,部分升高到+5价,根据电子得失守恒可知转移5个电子,则反应电子转移的方向和数目可表示为 。
。
b.以上反应中氧化剂与还原剂的物质的量之比为5:1。
c.若有21.3g Cl2参加反应,物质的量是21.3g÷71g/mol=0.3mol。由于消耗3mol氯气转移5mol电子,则转移的电子数为0.5NA。

 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案【题目】下图所示的实验,不能达到实验目的的是
A | B | C | D |
|
|
|
|
结合秒表测量锌与硫酸的反应速率 | 验证温度对化学平衡移动的影响 | 探究精炼铜的原理 | 证明酸性 CH3COOH>H2CO3>H3BO3 |
A. A B. B C. C D. D
【题目】某同学进行下列实验:
操作 | 现象 |
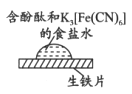
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水
| 放置一段时间后,生铁片上出现如图所示“斑痕”。边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈
|
下列对实验现象解释不正确的是
A. 中心区为蓝色的原因是铁失电子被氧化,Fe2+与K3[Fe(CN)6]反应生成蓝色沉淀
B. 边缘处为红色的原因是发生吸氧腐蚀,生成了OH-,使溶液中c(OH-)>c(H+)
C. 边缘处为红色的原因是发生析氢腐蚀,消耗了H+,打破了水的电离平衡,使c(OH-)>c(H+)
D. 交界处出现铁锈的原因是4Fe2++8OH-+O2+2H2O=4Fe(OH)3,Fe(OH)3分解得到铁锈