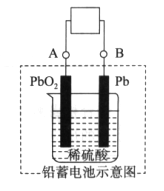
题目内容
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法正确的是

A. 简单氢化物的熔沸点W>Z,是因为W的非金属性强
B. 单核离子的半径:Y2+>X+
C. 溴与元素M同主族,最高价氧化物对应的水化物酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
【答案】D
【解析】
W、X、Y、Z、N、M六种主族元素,根据它们在周期表中位置可知,W为O元素、X为Na、Y为Mg、Z为S、M为Cl、N为Ge元素,结合物质的性质和元素周期律解答。
W、X、Y、Z、N、M六种主族元素,根据它们在周期表中位置可知,W为O元素、X为Na、Y为Mg、Z为S、M为Cl、N为Ge元素,则
A.W为O、Z为S元素,由于O对应的氢化物水分子间可形成氢键,其沸点较高,则水分子的沸点较高,故A错误;
B.Na+、Mg2+离子含有的电子层相同时,离子的核电荷数越大,离子半径越小,则离子半径Na+>Mg2+,故B错误;
C.溴与元素M(Cl)同主族,非金属性Br<Cl,则Br元素的最高价氧化物的水化物的酸性比Cl元素弱,故C错误;
D.N为Ge元素,Ge元素位于金属与非金属的分界线附近,Ce的单质可作半导体材料,故D正确;
故答案选D。

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目