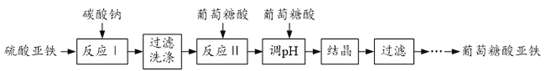
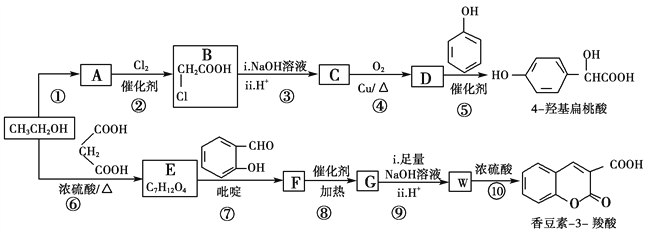
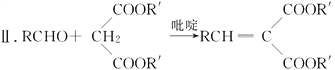
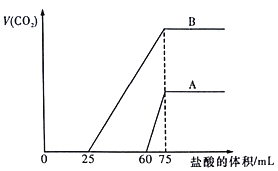
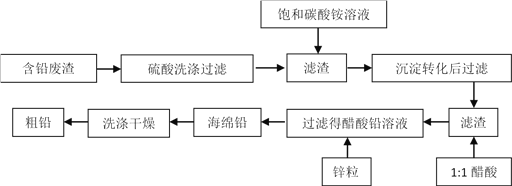
题目内容
【题目】在一定条件下,N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是
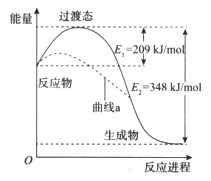
A. 该反应放出了348 kJ的热量
B. 曲线a可能是反应使用了催化剂
C. 断键吸收能量之和大于成键释放能量之和
D. N2O(g)+NO(g)=N2(g)+NO2(g) ![]() =-139kJ/mol
=-139kJ/mol
【答案】B
【解析】A. 该反应若生成1mol N2则放出了348 kJ的热量,选项A错误;B. 曲线a可能是反应使用了催化剂,改变了反应历程,降低了活化能但不能改变焓变,选项B正确;C、断键吸收能量,成键释放能量,此反应是放热反应,因此断键吸收能量小于成键释放能量,选项C错误;C、根据能量变化图,N2O(g)+NO(g) = N2(g)+NO2(g) △H=-348kJ/mol,选项D错误;答案选B。

练习册系列答案
相关题目