题目内容
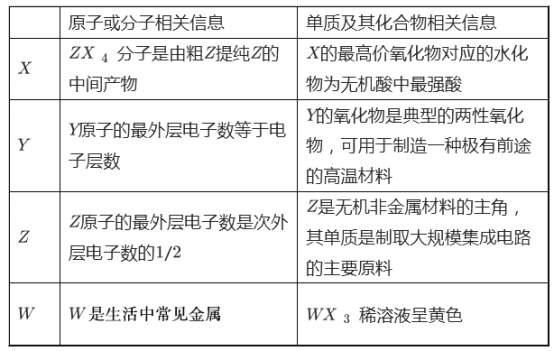
【题目】R、T、V、X、Y分别代表原子序数依次增大的短周期主族元素,在已发现的元素里R的原子半径最小;T、V同主族,T与Y可组成共价化合物TY3;X的晶体熔点高、硬度大、有脆性,在常温下化学性质不活泼.Z元素基态原子核外M能层上p轨道与d轨道的电子总数相等.
请回答下列问题:
(1)Z元素基态原子的电子排布式是 .
(2)利用价层电子对互斥理论判断TY3的空间构型是 .
(3)V、X、Y的单质形成的晶体,熔点由高到低的排列顺序是(填化学式);LiTR4为近年来储氢材料领域的研究热点,其中TR4﹣的电子式为;V的氢氧化物作弱酸时有类似TR4﹣的离子产生,其电离方程式为 .
(4)Y的二氧化物为一种气体,它是新一代饮用水的消毒剂、可用NaYO3与浓盐酸反应制取,在该反应中氧化剂与还原剂的物质的量之比为1:1,其化学方程式为 .
【答案】
(1)1s22s22p63s23p63d64s2
(2)平面三角形
(3)Si>Al>Cl2; ;Al(OH)3+H2OH++[Al(OH)4]﹣
;Al(OH)3+H2OH++[Al(OH)4]﹣
(4)2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O
【解析】解:R、T、V、X、Y分别代表原子序数依次增大的短周期主族元素,在已发现的元素里R的原子半径最小,则R为H元素;X的晶体熔点高、硬度大、有脆性,在常温下化学性质不活泼,则X为Si元素;T与Y可组成共价化合物TY3 , 而且Y的原子序数大于Si,V的原子序数小于Si,则V为B元素,Y为Cl元素,所以共价化合物TY3为BCl3;T、V同主族,则V为Al元素;Z元素基态原子核外M能层上p轨道与d轨道的电子总数相等,即M能层上p轨道与d轨道的电子总数都是6,所以其电子排布为1s22s22p63s23p63d64s2 , Z为Fe元素,(1)Z为Fe元素,其原子核外有26个电子,其电子排布式为1s22s22p63s23p63d64s2 , 故答案为:1s22s22p63s23p63d64s2;(2)BCl3中B原子的价层电子对数=3+ ![]() (3﹣3×1)=3,属于sp2杂化,其分子构型为平面三角形;故答案为:平面三角形;(3)Si属于原子晶体、Al属于金属晶体、Cl2属于分子晶体,则熔点由高到低的排列顺序是Si>Al>Cl2;LiBH4为近年来储氢材料领域的研究热点,其中BH4﹣的电子式为
(3﹣3×1)=3,属于sp2杂化,其分子构型为平面三角形;故答案为:平面三角形;(3)Si属于原子晶体、Al属于金属晶体、Cl2属于分子晶体,则熔点由高到低的排列顺序是Si>Al>Cl2;LiBH4为近年来储氢材料领域的研究热点,其中BH4﹣的电子式为  ;Al的氢氧化物作弱酸时有类似BH4﹣的离子产生,其电离方程式为Al(OH)3+H2OH++[Al(OH)4]﹣ . 故答案为:Si>Al>Cl2;
;Al的氢氧化物作弱酸时有类似BH4﹣的离子产生,其电离方程式为Al(OH)3+H2OH++[Al(OH)4]﹣ . 故答案为:Si>Al>Cl2;  ;Al(OH)3+H2OH++[Al(OH)4]﹣;(4)Cl的二氧化物为一种气体,它是新一代饮用水的消毒剂、可用NaYO3与浓盐酸反应制取,在该反应中氧化剂与还原剂的物质的量之比为1:1,其化学方程式为2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O;故答案为:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O.
;Al(OH)3+H2OH++[Al(OH)4]﹣;(4)Cl的二氧化物为一种气体,它是新一代饮用水的消毒剂、可用NaYO3与浓盐酸反应制取,在该反应中氧化剂与还原剂的物质的量之比为1:1,其化学方程式为2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O;故答案为:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O.
R、T、V、X、Y分别代表原子序数依次增大的短周期主族元素,在已发现的元素里R的原子半径最小,则R为H元素;X的晶体熔点高、硬度大、有脆性,在常温下化学性质不活泼,则X为Si元素;T与Y可组成共价化合物TY3 , 而且Y的原子序数大于Si,V的原子序数小于Si,则V为B元素,Y为Cl元素,所以共价化合物TY3为BCl3;T、V同主族,则V为Al元素;Z元素基态原子核外M能层上p轨道与d轨道的电子总数相等,即M能层上p轨道与d轨道的电子总数都是6,所以其电子排布为1s22s22p63s23p63d64s2 , 为Fe元素,结合元素周期律与元素化合物性质解答.

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案【题目】用如图装置研究电化学原理,下列分析中错误的是( ) 
选项 | 连接 | 电极材料 | 分析 | |
a | b | |||
A | K1 K2 | 石墨 | 铁 | 模拟铁的吸氧腐蚀 |
B | K1 K2 | 锌 | 铁 | 模拟钢铁防护中牺牲阳极的阴极保护法 |
C | K1 K3 | 石墨 | 铁 | 模拟电解饱和食盐水 |
D | K1 K3 | 铁 | 石墨 | 模拟钢铁防护中外加电流的阴极保护法 |
A.A
B.B
C.C
D.D
【题目】异丙苯( ![]() )氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下: 氧化:
)氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下: 氧化: ![]() +O→
+O→ ![]() (异丙苯过氧氢)
(异丙苯过氧氢)
分解: ![]()
![]()
![]() (丙嗣)
(丙嗣)
已知:
物质 | 丙酮 | 苯酚 | 异丙苯 |
密度(g/mL) | 0.7898 | 1.0722 | 0.8640 |
沸点/°C | 56.5 | 182 | 153 |
完成下列填空:
(1)X物质是;Y物质是 .
(2)浓硫酸的作用是 , 其优点是用量少,可能的缺点是(写一条).
(3)Z物质最适宜选择(选填编号).a.NaOH b.Na2CO3 c.NaHCO3 d.CaCO3
(4)步骤⑥分馏,工业上在分馏塔中进行,如图  ,产品T是 , 请说明理由 . 废水中苯酚的含量,可根据苯酚与溴水的反应,用以下方法测定: ①把20.00mL废水、20mLKBrO3和KBr混合溶液[其中:c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L]置于锥形瓶中,再加入10mL6mol/L的盐酸,迅速盖好盖子,摇动锥形瓶.
,产品T是 , 请说明理由 . 废水中苯酚的含量,可根据苯酚与溴水的反应,用以下方法测定: ①把20.00mL废水、20mLKBrO3和KBr混合溶液[其中:c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L]置于锥形瓶中,再加入10mL6mol/L的盐酸,迅速盖好盖子,摇动锥形瓶.
②充分反应后,稍松开瓶塞,从瓶塞和瓶壁间缝隙迅速加入10%KI溶液10mL(过量),迅速加盖,充分摇匀.加入少许淀粉溶液.
③用0.0250mol/LNa2S2O3标准溶液滴定至终点.用去Na2S2O3溶液22.48mL.
(5)已知:BrO3﹣+5Br﹣+6H+→3Br2+3H2O;写出苯酚与浓溴水反应的化学方程式;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是 .
(6)已知:I2+2Na2S2O3→2NaI+Na2S4O6;滴定终点的现象是;该废水中苯酚的浓度是mol/L(保留4位小数).