题目内容
【题目】有关物质的转化关系如图所示(部分物质与条件已略去).已知A是由两种元素组成的黑色粉末,B由两种元素组成、其摩尔质量为65gmol﹣1 , C是空气中含量最多的单质,D是白色粉末且焰色反应呈黄色,E是一种紫红色金属,F是一种无色气体单质,H是一种红棕色气体,I是最常见的液体,K是一种强碱. 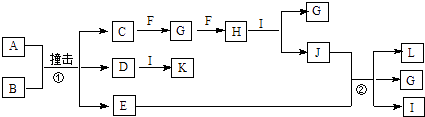
(1)F的化学式为 .
(2)K的电子式为 .
(3)写出反应①的化学方程式:
(4)写出反应②的离子方程式: .
【答案】
(1)O2
(2)![]()
(3)2NaN3+CuO ![]() Na2O+3N2↑+Cu
Na2O+3N2↑+Cu
(4)3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O
【解析】解:C是空气中含量最多的单质,则C为N2 , D是白色粉末且焰色反应呈黄色,D中含有钠元素,I是最常见的液体,则I为H2O,K是一种强碱,D与I反应生成K,则K为NaOH,所以D为Na2O,E是一种紫红色金属,则E为Cu,A是由两种元素组成的黑色粉末,B由两种元素组成、其摩尔质量为65gmol﹣1 , A、B反应生成C、D、E,结合元素守恒可知,A为CuO,B为NaN3 , F是一种无色气体单质,H是一种红棕色气体,则H为NO2 , 根据转化关系可知,F为O2 , G为NO,二氧化氮与水反应生成J为HNO3 , 硝酸和铜反应生成L为Cu(NO3)2 , (1)根据上面的分析可知,F的化学式为O2 , 所以答案是:O2;(2)K为NaOH,K的电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(3)反应①的化学方程式为:2NaN3+CuO
;(3)反应①的化学方程式为:2NaN3+CuO ![]() Na2O+3N2↑+Cu, 所以答案是:2NaN3+CuO
Na2O+3N2↑+Cu, 所以答案是:2NaN3+CuO ![]() Na2O+3N2↑+Cu;(4)反应②为铜 与稀硝酸反应生成硝酸铜与一氧化氮,反应的离子方程式为3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O,
Na2O+3N2↑+Cu;(4)反应②为铜 与稀硝酸反应生成硝酸铜与一氧化氮,反应的离子方程式为3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O,
所以答案是:3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O.

【题目】某化学反应2A(g)B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验 | 时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为mol/(Lmin).
(2)在实验2,A的初始浓度c2=mol/L,推测实验2中还隐含的条件是 .
(3)设实验3的反应速率为v3 , 实验1的反应速率为v1 , 则v3v1(填>、<、=),且c31.0mol/L(填>、<、=)
(4)比较实验4和实验1,可推测该反应是反应(选填“吸热”、“放热”).理由是 .
【题目】草酸(H2C2O4)是一种重要的化工原料,常温下其K1=5.4×10﹣2、K2=5.4×10﹣5 . 常温下几种草酸盐溶液的pH见下表:
编号 | ① | ② | ③ |
溶液 | 0.01mol/L KHC2O4 | 0.01mol/L K2C2O4 | 溶液①与溶液②等体积混合 |
pH | 3.1 | 8.1 | 未测定 |
下列溶液中离子的物质的量浓度关系正确的是( )
A.①中:c(K+)>c(HC2O ![]() )>c(C2O
)>c(C2O ![]() )>c(H+)>c(OH﹣)
)>c(H+)>c(OH﹣)
B.②中:c(K+)>c(C2O ![]() )>c(HC2O
)>c(HC2O ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
C.③中:c(K+)>c(HC2O ![]() )>c(C2O
)>c(C2O ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
D.③中:2c(OH﹣)+c(C2O ![]() )=3c(H2C2O4)+c(HC2O
)=3c(H2C2O4)+c(HC2O ![]() )+2c(H+)
)+2c(H+)
【题目】下列关于实验现象的描述正确的是( )
选项 | 实验操作 | 实验现象 |
A | 将盛有CH4与Cl2的集气瓶放在光亮处一段时间 | 气体颜色变浅,瓶内壁附有油状物 |
B | 将乙烯在空气中点燃 | 火焰呈蓝色并伴有黑烟 |
C | 向盛有苯的试管中加入几滴酸性KMnO4溶液,充分振荡 | 液体分层,溶液紫色褪去 |
D | 将蔗糖溶液与稀硫酸混合水浴加热,取反应后的溶液少量,加入几滴新制的Cu(OH)2悬浊液加热 | 出现砖红色沉淀 |
A.A
B.B
C.C
D.D