题目内容
【题目】X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素,有关信息如表:
(1)W(OH)2 在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程为__________。
(2)X的简单阴离子的结构示意图为______,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为______ 。
(3)ZX4分子中化学键类型______,Z的氧化物在通讯领域用来作______。锗与Z是同一主族元素,门捷列夫曾预言了这一元素的存在,它用来制造半导体晶体管,最新研究表明:有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应但在有H 2 O 2 存在时可与NaOH 溶液反应生成锗酸盐,其方程式为______ 。
(4)在50 mL l mol·L -1 的YX 3 溶液中逐滴加入0.5 mol·L -1 的NaOH溶液,得到1.56 g沉淀,则加入NaOH溶液的体积可能___ 种情况(填一或二)。
【答案】 4Fe(OH)2+O2+2H2O![]() 4Fe(OH)3
4Fe(OH)3 ![]() 6H++Al2O3
6H++Al2O3![]() 2Al3++3H2O 极性共价键 光导纤维 Ge+2 H2O2+2NaOH
2Al3++3H2O 极性共价键 光导纤维 Ge+2 H2O2+2NaOH![]() Na2GeO3+3H2O 二
Na2GeO3+3H2O 二
【解析】X、Y、Z为短周期元素,X的最高价氧化物对应的水化物为无机酸中最强酸,则X为Cl;Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料,Y原子的最外层电子数等于电子层数,则Y为Al;Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料、,原子的最外层电子数是次外层电子数的![]() ,则Z为Si;W原子的最外层电子数小于4,常见化合价有+3、+2,
,则Z为Si;W原子的最外层电子数小于4,常见化合价有+3、+2,![]() 稀溶液呈黄色,则W为Fe;
稀溶液呈黄色,则W为Fe;
(1) ![]() 在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为: 4Fe(OH)2+O2+2H2O
在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为: 4Fe(OH)2+O2+2H2O![]() 4Fe(OH)3 ;正确答案:4Fe(OH)2+O2+2H2O
4Fe(OH)3 ;正确答案:4Fe(OH)2+O2+2H2O![]() 4Fe(OH)3 。
4Fe(OH)3 。
(2)X的简单阴离子为![]() ,结构示意图为
,结构示意图为![]() ,X的最高价氧化物对应水化物为高氯酸,Y的氧化物为氧化铝,反应的离子方程式为:
,X的最高价氧化物对应水化物为高氯酸,Y的氧化物为氧化铝,反应的离子方程式为:![]() ,正确答案:
,正确答案:![]() ;
;![]() 。
。
(3)ZX4分子为四氯化硅,为共价化合物,含有极性共价键;Z的氧化物为二氧化硅,在通讯领域用来作光导纤维;锗与NaOH 溶液、H 2 O 2溶液反应生成锗酸钠和水,方程式为Ge+2 H2O2+2NaOH![]() Na2GeO3+3H2O;正确答案:Ge+2 H2O2+2NaOH
Na2GeO3+3H2O;正确答案:Ge+2 H2O2+2NaOH![]() Na2GeO3+3H2O。
Na2GeO3+3H2O。
(4)50 mLl mol·L -1 的氯化铝溶液中氯化铝的物质的量0.05×1=0.05 mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量0.05×78=3.9g>1.56 g,说明有两种情况:一为沉淀不完全,只生成![]() 沉淀;另一种情况为沉淀部分溶解,既生成
沉淀;另一种情况为沉淀部分溶解,既生成![]() 沉淀,又生成
沉淀,又生成![]() ;
;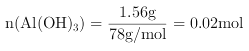 ;①若碱不足,由
;①若碱不足,由![]() ═
═![]() ↓可以知道,NaOH的物质的量0.02×3=0.06 mol,加入NaOH溶液的体积为0.06/0.5=0.12L ;②沉淀部分溶解,既生成
↓可以知道,NaOH的物质的量0.02×3=0.06 mol,加入NaOH溶液的体积为0.06/0.5=0.12L ;②沉淀部分溶解,既生成![]() 沉淀,又生成
沉淀,又生成![]() ,则:
,则:
![]() ═
═![]() ↓
↓
0.05 0.15 0.1
溶解的氢氧化铝为0.1-0.02=0.08 mol;
![]() ═
═![]()
0.08 0.08
则消耗的碱的物质的量为0.15+0.08=0.23 mol;加入NaOH溶液的体积为0.23/0.5=0.46 L所以加入NaOH溶液的体积可能120mL或 460mL;正确答案:二。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】草酸(H2C2O4)是一种重要的化工原料,常温下其K1=5.4×10﹣2、K2=5.4×10﹣5 . 常温下几种草酸盐溶液的pH见下表:
编号 | ① | ② | ③ |
溶液 | 0.01mol/L KHC2O4 | 0.01mol/L K2C2O4 | 溶液①与溶液②等体积混合 |
pH | 3.1 | 8.1 | 未测定 |
下列溶液中离子的物质的量浓度关系正确的是( )
A.①中:c(K+)>c(HC2O ![]() )>c(C2O
)>c(C2O ![]() )>c(H+)>c(OH﹣)
)>c(H+)>c(OH﹣)
B.②中:c(K+)>c(C2O ![]() )>c(HC2O
)>c(HC2O ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
C.③中:c(K+)>c(HC2O ![]() )>c(C2O
)>c(C2O ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
D.③中:2c(OH﹣)+c(C2O ![]() )=3c(H2C2O4)+c(HC2O
)=3c(H2C2O4)+c(HC2O ![]() )+2c(H+)
)+2c(H+)
【题目】下列关于实验现象的描述正确的是( )
选项 | 实验操作 | 实验现象 |
A | 将盛有CH4与Cl2的集气瓶放在光亮处一段时间 | 气体颜色变浅,瓶内壁附有油状物 |
B | 将乙烯在空气中点燃 | 火焰呈蓝色并伴有黑烟 |
C | 向盛有苯的试管中加入几滴酸性KMnO4溶液,充分振荡 | 液体分层,溶液紫色褪去 |
D | 将蔗糖溶液与稀硫酸混合水浴加热,取反应后的溶液少量,加入几滴新制的Cu(OH)2悬浊液加热 | 出现砖红色沉淀 |
A.A
B.B
C.C
D.D