��Ŀ����
����Ŀ��������� ![]() ���������ǹ�ҵ�������Ӻͱ�ͪ����Ҫ�ķ������䷴Ӧ���������£� ������
���������ǹ�ҵ�������Ӻͱ�ͪ����Ҫ�ķ������䷴Ӧ���������£� ������ ![]() +O��
+O�� ![]() ������������⣩
������������⣩
�ֽ⣺ ![]()
![]()
![]() �����ã�
�����ã�
��֪��
���� | ��ͪ | ���� | ����� |
�ܶȣ�g/mL�� | 0.7898 | 1.0722 | 0.8640 |
�е�/��C | 56.5 | 182 | 153 |
���������գ�
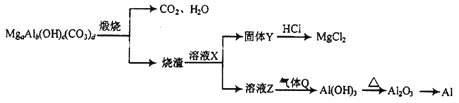
��1��X��������Y������ ��
��2��Ũ����������� �� ���ŵ��������٣����ܵ�ȱ������дһ������
��3��Z����������ѡ����ѡ���ţ���a��NaOH b��Na2CO3 c��NaHCO3 d��CaCO3
��4���������ҵ���ڷ������н��У���ͼ  ����ƷT�� �� ��˵������ �� ��ˮ�б��ӵĺ������ɸ��ݱ�������ˮ�ķ�Ӧ�������·����ⶨ�� �ٰ�20.00mL��ˮ��20mLKBrO3��KBr�����Һ[���У�c��KBrO3��=0.0100mol/L��c��KBr��=0.0600mol/L]������ƿ�У��ټ���10mL6mol/L�����ᣬѸ�ٸǺø��ӣ�ҡ����ƿ��
����ƷT�� �� ��˵������ �� ��ˮ�б��ӵĺ������ɸ��ݱ�������ˮ�ķ�Ӧ�������·����ⶨ�� �ٰ�20.00mL��ˮ��20mLKBrO3��KBr�����Һ[���У�c��KBrO3��=0.0100mol/L��c��KBr��=0.0600mol/L]������ƿ�У��ټ���10mL6mol/L�����ᣬѸ�ٸǺø��ӣ�ҡ����ƿ��
�ڳ�ַ�Ӧ�����ɿ�ƿ������ƿ����ƿ�ڼ��϶Ѹ�ټ���10%KI��Һ10mL����������Ѹ�ټӸǣ����ҡ�ȣ���������������Һ��
����0.0250mol/LNa2S2O3����Һ�ζ����յ㣮��ȥNa2S2O3��Һ22.48mL��
��5����֪��BrO3��+5Br��+6H+��3Br2+3H2O��д��������Ũ��ˮ��Ӧ�Ļ�ѧ����ʽ����1�����ᡢ�ڢڲ���KI��Һ��ҪѸ�ٸǺø��ӵ�ԭ���� ��
��6����֪��I2+2Na2S2O3��2NaI+Na2S4O6���ζ��յ�����������÷�ˮ�б��ӵ�Ũ����mol/L������4λС������
���𰸡�
��1����������������������
��2��������Ũ�����ʹ�л������ˮ�ȸ���Ӧ��Ũ�������л����Ϸų������ȣ�ʹ��Ӧ�¶ȹ��ߣ������ڷ�Ӧ���У���Ũ����ḯʴ�豸�ȣ�
��3��c
��4����ͪ����ͪ�ķе��
��5�� �����ӷ�
�����ӷ�
��6������ɫ��Ϊ��ɫ�����ɫ���ǣ��Ұ�����ڲ���ɫ��0.0053
���������⣺��������������������Ӻͱ�ͪ���ɸ���ķ�Ӧ��Ϣ��������������ڷ�Ӧ�����з���������Ӧ����  ���ڢ������������
���ڢ������������  ��δ��Ӧ�����������ѭ�����ã�
��δ��Ӧ�����������ѭ�����ã�  �ڢ�����Ũ���������������·ֽ�õ�
�ڢ�����Ũ���������������·ֽ�õ� ![]() ��
�� ![]() ���ڢ��м���Z��Ŀ�����к����ᣬ�Ҳ����뱽�ӷ�Ӧ��������̼�����ƣ�Ȼ�����ˮϴ�ӣ��پ�������ñ�ͪ�����ӣ���1����������ķ�����֪��X������ ���������������Y������ ������� ���Դ��ǣ�������������������������2��
���ڢ��м���Z��Ŀ�����к����ᣬ�Ҳ����뱽�ӷ�Ӧ��������̼�����ƣ�Ȼ�����ˮϴ�ӣ��پ�������ñ�ͪ�����ӣ���1����������ķ�����֪��X������ ���������������Y������ ������� ���Դ��ǣ�������������������������2��  �ڢ�����Ũ���������������·ֽ�õ�
�ڢ�����Ũ���������������·ֽ�õ� ![]() ��
�� ![]() ������Ũ����������� ���������ŵ��������٣����ܵ�ȱ���� Ũ�����ʹ�л������ˮ�ȸ���Ӧ��Ũ�������л����Ϸų������ȣ�ʹ��Ӧ�¶ȹ��ߣ������ڷ�Ӧ���У���Ũ����ḯʴ�豸�ȣ���
������Ũ����������� ���������ŵ��������٣����ܵ�ȱ���� Ũ�����ʹ�л������ˮ�ȸ���Ӧ��Ũ�������л����Ϸų������ȣ�ʹ��Ӧ�¶ȹ��ߣ������ڷ�Ӧ���У���Ũ����ḯʴ�豸�ȣ���
���Դ��ǣ�������Ũ�����ʹ�л������ˮ�ȸ���Ӧ��Ũ�������л����Ϸų������ȣ�ʹ��Ӧ�¶ȹ��ߣ������ڷ�Ӧ���У���Ũ����ḯʴ�豸�ȣ�����3����������ķ�����֪��Z������̼�����ƣ���ѡc����4����������У����ڱ�ͪ�ķе���ڱ��ӣ���TΪ��ͪ��PΪ���ӣ����Դ��ǣ���ͪ�� ��ͪ�ķе�ͣ���5��������Ũ��ˮ��Ӧ�Ļ�ѧ����ʽΪ 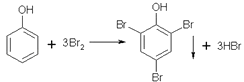 ���������ӷ������Ե�1�����ᡢ�ڢڲ���KI��Һ��ҪѸ�ٸǺø��ӣ���ֹ��ӷ������Դ��ǣ�
���������ӷ������Ե�1�����ᡢ�ڢڲ���KI��Һ��ҪѸ�ٸǺø��ӣ���ֹ��ӷ������Դ��ǣ�  �����ӷ�����6����Һ���е��ۣ����ﵽ�ζ��յ�ʱ���ⷴӦ��ȫ�����Եζ��յ�������� ����ɫ��Ϊ��ɫ�����ɫ���ǣ��Ұ�����ڲ���ɫ��20mLKBrO3��KBr�����Һ[���У�c��KBrO3��=0.0100mol/L��c��KBr��=0.0600mol/L]������ƿ�У��ټ���10mL6mol/L�����ᣬ���ݷ���ʽBrO3��+5Br��+6H+��3Br2+3H2O��֪�����ɵ�������ʵ���Ϊ3��0.0100mol/L��0.02L=6��10��4 mol�����ݷ�ӦI2+2Na2S2O3��2NaI+Na2S4O6��֪��������⻯�ط�Ӧ���ɵĵ�����ʵ���Ϊ0.0250mol/L��0.02248L��
�����ӷ�����6����Һ���е��ۣ����ﵽ�ζ��յ�ʱ���ⷴӦ��ȫ�����Եζ��յ�������� ����ɫ��Ϊ��ɫ�����ɫ���ǣ��Ұ�����ڲ���ɫ��20mLKBrO3��KBr�����Һ[���У�c��KBrO3��=0.0100mol/L��c��KBr��=0.0600mol/L]������ƿ�У��ټ���10mL6mol/L�����ᣬ���ݷ���ʽBrO3��+5Br��+6H+��3Br2+3H2O��֪�����ɵ�������ʵ���Ϊ3��0.0100mol/L��0.02L=6��10��4 mol�����ݷ�ӦI2+2Na2S2O3��2NaI+Na2S4O6��֪��������⻯�ط�Ӧ���ɵĵ�����ʵ���Ϊ0.0250mol/L��0.02248L�� ![]() =2.81��10��4 mol�������뱽�ӷ�Ӧ��������ʵ���Ϊ6��10��4 mol��2.81��10��4 mol=3.19��10��4 mol�����ݷ�Ӧ
=2.81��10��4 mol�������뱽�ӷ�Ӧ��������ʵ���Ϊ6��10��4 mol��2.81��10��4 mol=3.19��10��4 mol�����ݷ�Ӧ  ��֪�����ӵ����ʵ���Ϊ3.19��10��4 mol��
��֪�����ӵ����ʵ���Ϊ3.19��10��4 mol�� ![]() =1.06��10��4 mol�����Է�ˮ�б��ӵ�Ũ����
=1.06��10��4 mol�����Է�ˮ�б��ӵ�Ũ���� ![]() =0.0053mol/L�����Դ��ǣ�����ɫ��Ϊ��ɫ�����ɫ���ǣ��Ұ�����ڲ���ɫ��0.0053��
=0.0053mol/L�����Դ��ǣ�����ɫ��Ϊ��ɫ�����ɫ���ǣ��Ұ�����ڲ���ɫ��0.0053��

 ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д�