题目内容
【题目】3-四氢呋喃甲醇是合成农药呋虫胺的中间体,其合成路线如下:

已知:① RCl ![]() NCN
NCN ![]() RCOOH
RCOOH
② R1COOR2 + R318OH ![]() R1CO18OR3 + R2OH
R1CO18OR3 + R2OH
③ R1COOR2 ![]() R1CH2OH + R2OH
R1CH2OH + R2OH
请回答下列问题:
(1)A生成B的反应类型是__________,B中含有的官能团是___________。
(2)D发生酯化反应生成E的化学方程式为___________。
(3)3-四氢呋喃甲醇有多种同分异构体,请写出其中两种符合下列条件的有机物的结构简式:______________________。
①能发生水解反应 ②分子中有3个甲基
(4)G的结构简式为__________。
(5)生成G的过程中常伴有副反应发生,请写出一定条件下生成高分子聚合物的化学方程式:________。
(6)还可以利用![]() 与K发生加成反应合成3-四氢呋喃甲醇,写出K和H的结构简式。___________________、__________________。
与K发生加成反应合成3-四氢呋喃甲醇,写出K和H的结构简式。___________________、__________________。
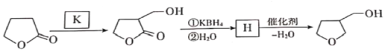
【答案】取代反应 氯原子(-Cl)、羧基(-COOH) HOOCCH2COOH+2 CH3CH2OH![]() CH3CH2OOCCH2COOCH2CH3+2H2O
CH3CH2OOCCH2COOCH2CH3+2H2O  、
、 、
、 (任写2种)
(任写2种)  n
n
![]()
 +(n-1)CH3CH2OH HCHO
+(n-1)CH3CH2OH HCHO 
【解析】
由A的分子式、C的结构,结合反应条件,可知A为CH3COOH,A与氯气发生甲基上的取代反应生成B,B为ClCH2COOH,B发生羧基与碳酸钠复分解反应、再发生取代反应生成C。由F的结构、结合信息①,可知C酸化生成D,D为HOOCCH2COOH,结合(2)的提示,D与乙醇发生酯化反应生成E,E为CH3CH2OOCCH2COOCH2CH3;E与环氧乙烷发生开环加成生成F。F发生信息②中酯交换反应脱去1分子CH3CH2OH生成G,故G为 ,G发生信息③中的反应生成
,G发生信息③中的反应生成 ,然后脱去1分子水生成
,然后脱去1分子水生成 ,据此分析解答。
,据此分析解答。
(1)A生成B是乙酸的甲基上H原子比氯原子替代,属于取代反应;B为ClCH2COOH,B中含有的官能团是:羧基、氯原子,故答案为:取代反应;羧基、氯原子;
(2)D为HOOCCH2COOH,D与乙醇发生酯化反应生成E,反应化学方程式为HOOCCH2COOH+2 CH3CH2OH![]() CH3CH2OOCCH2COOCH2CH3+2 H2O,故答案为:HOOCCH2COOH+2 CH3CH2OH
CH3CH2OOCCH2COOCH2CH3+2 H2O,故答案为:HOOCCH2COOH+2 CH3CH2OH![]() CH3CH2OOCCH2COOCH2CH3+2 H2O;
CH3CH2OOCCH2COOCH2CH3+2 H2O;
(3)3-四氢呋喃甲醇的两种同分异构体符合下列条件:①能发生水解反应,说明含有酯基,②分子中有3个甲基,可以是: 、
、 、
、 ,故答案为:
,故答案为: 、
、 、
、 (任写2种);
(任写2种);
(4)根据上述分析可知,G为: ,故答案为:
,故答案为: ;
;
(5)生成G的过程中常伴有副反应发生,一定条件下生成高分子聚合物的化学方程式:n
![]()
 +(n-1)CH3CH2OH,故答案为:n
+(n-1)CH3CH2OH,故答案为:n
![]()
 +(n-1)CH3CH2OH;
+(n-1)CH3CH2OH;
(6)![]() 与K发生加成反应生成
与K发生加成反应生成 ,故K为HCHO,
,故K为HCHO, 发生信息③中反应生成H为
发生信息③中反应生成H为 ,然后脱去1分子水生成
,然后脱去1分子水生成 ,故答案为:HCHO;
,故答案为:HCHO; 。
。

【题目】某小组同学对FeCl3与KI的反应进行探究。
(初步探究)室温下进行下表所列实验。
序号 | 操作 | 现象 |
实验Ⅰ | 取5 mL 0.1 mol·L-1 KI溶液,滴加0.1 mol·L-1FeCl3溶液5~6滴(混合溶液pH=5) | 溶液变为棕黄色 |
实验Ⅱ | 取2 mL实验Ⅰ反应后的溶液,滴加2滴0.1 mol·L-1 KSCN溶液 | 溶液呈红色 |
(1)证明实验Ⅰ中有I2生成,加入的试剂为 __________。
(2)写出实验Ⅰ反应的离子方程式:_________________。
(3)结合上述实验现象可以证明Fe3+与I-发生可逆反应,原因是_____________________。
(深入探究)20 min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(4)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:________,20 min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是_____________(写出两条)。
(5)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I- + I2![]() I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:____________。
I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:____________。
(6)丙同学针对20 min后的实验现象继续提出假设:FeCl3与KI的反应、I-与I2的反应达到平衡需要一段时间,有可能20 min之前并未达到平衡。为验证该假设,丙同学用4支试管进行实验,得到了颜色由浅到深的四个红色溶液体系,具体实验方案为__________________。



