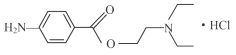
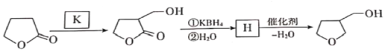题目内容
【题目】某化学实验兴趣小组的同学从海带中提取碘单质的实验流程图如下:

依据实验下列说法不正确的是( )
A. 从上述实验可以得出海带中含有可溶性的含碘化合物
B. 步骤⑤中可能发生的反应为:5I- + IO3- +6H+ ===3I2 +3H2O
C. 若步骤④中用CCl4做萃取剂,步骤⑥应取上层溶液得到后续的混合物C
D. 整个过程中的操作是利用了物质的溶解性实现了碘元素的富集、分离与提纯
【答案】B
【解析】
由流程可知,海带溶解后倾倒分离出残渣,混合物A酸化氧化后萃取分液得到混合物B,混合物B中含碘单质,步骤⑤中加NaOH后分离出的混合物C中含I-、IO3-,最后加硫酸发生5I-+IO3-+6H+═3I2+3H2O,又析出碘,达到碘元素的提取,据此分析解答。
A.由上述分析可知,海带中含有可溶性的含碘化合物,故A正确;
B.步骤⑤中碘与氢氧化钠溶液发生的反应可能为3I2+6OH-=5I-+IO3-+3H2O,故B错误;
C.若步骤④中用CCl4做萃取剂,有机层在下层,步骤⑤中碘与NaOH反应生成的含碘化合物易溶于水,进入水层,则步骤⑥应取上层溶液得到后续的混合物C,故C正确;
D.根据流程,结合上述分析,实验过程中是利用了物质的溶解性实现了碘元素的富集、分离与提纯,故D正确;
答案选B。

【题目】25 ℃时,部分物质的电离常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离常数 | 1.7×10-5 | K1=4.3×10-7,K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________。
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为______。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填序号),一定不变的是________(填序号)。一定变大的是________(填序号),
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E. c(CH3COO-)·c(H+)/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是____________(填序号)。