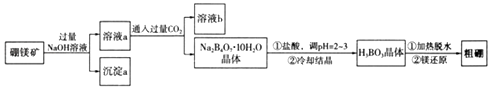
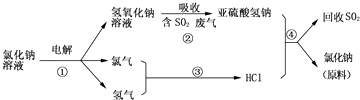
题目内容
【题目】(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是_________。
(2)25℃时,利用pH试纸测得0.1molL-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将_____(填“增大”、“减小”或“无法确定”)。
(3)25 ℃时,pH=3的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______(取近似值)
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是________点;在b点,溶液中各离子浓度由大到小的排列顺序是__________________________

【答案】 1:10 10-5mol·L-1 减小 10-3mol·L-1 a c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
【解析】(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,则c[Ba(OH)2]=5![]() 10-3mol/L,c(OH-)=1
10-3mol/L,c(OH-)=1![]() 10-2mol/L。pH=3的盐酸中,c(H+)=1
10-2mol/L。pH=3的盐酸中,c(H+)=1![]() 10-3mol/L。混合后溶液的pH=7,因为c(OH-)=10 c(H+),则氢氧化钡溶液和盐酸的体积之比是1:10。
10-3mol/L。混合后溶液的pH=7,因为c(OH-)=10 c(H+),则氢氧化钡溶液和盐酸的体积之比是1:10。
(2)25℃时,利用pH试纸测得0.1molL-1醋酸溶液的pH约为3,c(H+)=![]() mol/L,则可以估算出醋酸的电离常数为
mol/L,则可以估算出醋酸的电离常数为![]() mol/L;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,因为c(CH3COOH)变大后CH3COOH的电离程度变小,所以溶液中c(H+)/c(CH3COOH)的值将减小。
mol/L;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,因为c(CH3COOH)变大后CH3COOH的电离程度变小,所以溶液中c(H+)/c(CH3COOH)的值将减小。
(3)25 ℃时,pH=3的NH4Al(SO4)2中,c(H+)=10-3mol·L-1、c(OH-)=10-11mol·L-1,由电荷守恒,得2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3mol·L-1-10-11mol·L-1![]() 10-3mol·L-1.
10-3mol·L-1.
(4)NH4HSO4溶液中,NH4HSO4完全电离,NH4HSO4= NH4++H++SO42-,溶液的酸性主要由其电离产生的H+决定的,水的电离受到其电离产生H+的抑制;当与反应2NH4HSO4+2NaOH=Na2SO4+ (NH4)2SO4+2H2O恰好完成时,因铵根离子水解溶液仍显酸性,但是铵根水解促进了水的电离,水的电离程度达到最大,此后继续加入NaOH溶液,溶液中铵根离子的浓度逐渐减小,溶液的pH逐渐增大,水的电离程度逐渐减小。由图可知,a、b、c、d四个点中,a点代表的是2NH4HSO4+2NaOH=Na2SO4+ (NH4)2SO4+2H2O恰好完成时,所以水的电离程度最大的是a点;在a点c(Na+)=2c(SO42-)->c(NH4+),则在b点,c(Na+)>2c(SO42-), 由pH=7得c(OH-)=c(H+),所以溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42)->c(NH4+)>c(OH-)=c(H+)。