题目内容
【题目】化合物H是一种有机材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

已知:①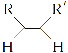
![]() RCHO+R′CHO
RCHO+R′CHO
②RCHO+R′CH2CHO![]()
![]() +H2O
+H2O
③![]()
请回答下列问题:
(1)芳香族化合物B的名称为________,1molB最多能与_____molH2加成,其加成产物等效氢共有_______种。
(2)由E生成F的反应类型为________,F分子中所含官能团的名称是_______。
(3)X的结构简式为________。
(4)写出D生成E的第①步反应的化学方程式______。
(5)G与乙醇发生酯化反应生成化合物Y,Y有多种同分异构体,其中符合下列条件的同分异构体有________种,写出其中任意一种的结构简式____。
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2;②其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1。
(6)根据题目所给信息,设计由乙醛和苯甲醛制备![]() 的合成路线(无机试剂任选)______。
的合成路线(无机试剂任选)______。
【答案】苯甲醛 4 6 加成反应 羧基、溴原子 ![]()
![]() +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
![]() +Cu2O↓+3H2O 4
+Cu2O↓+3H2O 4  (或
(或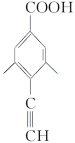 .
.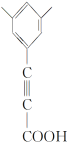 .
.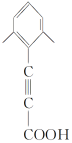 中任一种)
中任一种) 
【解析】
A发生信息①中氧化反应得到B、C,而B为芳香族化合物,故B为![]() 、C为CH3CHO,B与C发生信息②中的反应生成D为
、C为CH3CHO,B与C发生信息②中的反应生成D为![]() ,D发生氧化反应得到E为
,D发生氧化反应得到E为![]() ,E与溴发生加成反应生成F为
,E与溴发生加成反应生成F为![]() ,F发生消去反应生成G为
,F发生消去反应生成G为![]() ,由H的结构,结合信息③中的加成反应,可知X为
,由H的结构,结合信息③中的加成反应,可知X为![]() 。
。
(1)根据分析可知B为![]() ,名称为苯甲醛;苯环和醛基中的碳氧双键都可以与氢气发生加成反应,所以1molB最多能与4mol氢气发生加成反应,加成后生成
,名称为苯甲醛;苯环和醛基中的碳氧双键都可以与氢气发生加成反应,所以1molB最多能与4mol氢气发生加成反应,加成后生成![]() ,有6种环境的氢原子;
,有6种环境的氢原子;
(2)E到F为碳碳双键与溴的加成反应,F为![]() ,官能团为溴原子、羧基;
,官能团为溴原子、羧基;
(3)根据分析可知X为![]() ;
;
(4)D生成E的第①步反应为新制氢氧化铜氧化醛基的反应,方程式为:![]() +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
![]() +Cu2O↓+3H2O;
+Cu2O↓+3H2O;
(5)G(![]() )与乙醇发生酯化反应生成化合物Y,则Y的分子式为C11H10O2,其同分异构体满足:
)与乙醇发生酯化反应生成化合物Y,则Y的分子式为C11H10O2,其同分异构体满足:
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2,说明含有羧基;
②其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,说明分子结构对称,且应有两个处于对称位置的甲基,符合条件的同分异构体有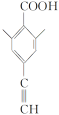 、
、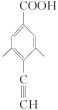 、
、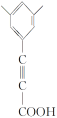 、
、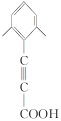 共4种;
共4种;
(6)原料为乙醛和苯甲醛,目标产物为![]() ,需要将苯甲醛的支链上的碳链加长,同时引入羧基,根据题目信息②两个醛基可以反应,加长碳链,同时保留一个醛基,将醛基氧化可以生成羧基,所以合成路线为
,需要将苯甲醛的支链上的碳链加长,同时引入羧基,根据题目信息②两个醛基可以反应,加长碳链,同时保留一个醛基,将醛基氧化可以生成羧基,所以合成路线为 。
。

【题目】下列有关实验的操作、现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向浓度均为0.10molL-1的KCl和KI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
B | 向Na2SO3溶液中先加入Ba(NO3)2溶液,然后再加入稀盐酸 | 生成白色沉淀,加入稀 盐酸,沉淀不溶解 |
|
C | 向盛有NH4Al(SO4)2溶液的试管中,滴加少量NaOH溶液 | 产生使湿润的红色石蕊试纸变蓝的气体 | NH4++OH- = NH3↑+H2O |
D | 测定等物质的量浓度的Na2CO3和NaClO的pH值 | Na2CO3>NaClO | 酸性:H2CO3<HClO |
A.AB.BC.CD.D
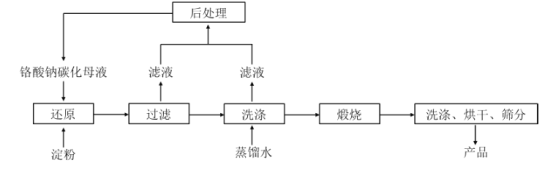
【题目】碱式硫酸铬[Cr(OH)SO4nH2O]常用于鞣制皮革,染料工业的活性黑染料、媒染剂。电镀废水中(主要含Cr2O72-、Cr3+、Fe3+、CN-、Cl-,少量Mg2+、Cu2+等离子),提取含铬废水中的铬并制成可用的碱式硫酸铬对污染治理和工业生产具有十分重要的意义。
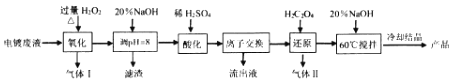
相关金属离子[co (Mn+)= 01 molL-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Cr3+ | Fe3+ | Mg2+ | Cu2+ |
开始沉淀的pH | 4.3 | 1.9 | 9.1 | 4.7 |
沉淀完全的pH | 5.6 | 3.2 | 11.1 | 6.7 |
回答下列问题:
(1)碱式硫酸铬中Cr的化合价为_________。
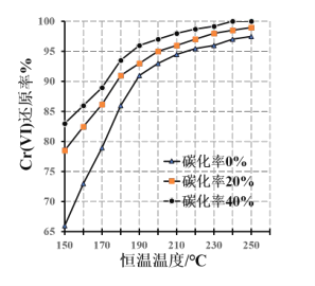
(2)“氧化”时需控制反应温度在50℃~90℃,原因___________。H2O2先将CN-氧化为无害气体除去,气体I成分是________;后在碱性条件下将Cr3+ 氧化为CrO42-,滤渣中主要含________ (填相关物质的化学式)。
(3)“酸化”时CrO42-可转化为Cr2O72-,其离子方程式为________。
(4)“离子交换”过程采用钠离子交换树脂,反应原理为Mn+ +nNaR=MRn+nNa+ ,则富集到钠离子交换树脂上的金属阳离子有_________(填离子符号)。
(5)处理1L0.1molL-1Cr2O72- 的废水,理论上需要H2C2O4的物质的量为_______ mol。
(6)废水中含有的Cl-常以K2CrO4溶液为指示剂,用AgNO3标准溶液滴定测其含量,利用Ag+与CrO42-生成的砖红色沉淀指示到达滴定终点。当溶液中Cl- 恰好完全沉淀(浓度等于1.0×10一5molL-1)时,溶液中c (Ag+)为_____molL-1 此时溶液中c(CrO42-)等于_______mo1L-1(已知Ag2CrO4、AgCl的Ksp分别约为2.0×10-12和和2.0×10 -10)。