��Ŀ����
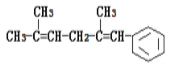
����Ŀ��1��2һ���ȱ��飨CH2ClCHClCH3����һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ��ñ�ϩ�ӳɷ��Ʊ�����Ҫ������Ϊ3һ�ȱ�ϩ��CH2=CHCH2Cl������Ӧԭ��Ϊ��
i .CH2 =CHCH3��g�� +C12��g��CH2ClCHClCH3��g�� ��H1=-134kJmol-1
ii . CH2 =CHCH3��g�� +C12��g��CH2= CHCH2Cl��g�� +HCl��g�� ��H2 =-102kJmol-1
��ش��������⣺
��1����֪��CH2 =CHCH2Cl ��g�� + HCl �� g��CH2ClCHClCH3��g��������Ӧ�Ļ��Ea������Ϊ132 kJmol-1�����淴Ӧ�Ļ��Ea���棩Ϊ__________ kJmol-1 ��
��2��ij�о�С�����ܱ������г���һ������C12��g����CH2 =CHCH3 �� g�����ֱ��� A��B���ֲ�ͬ���������·�����Ӧ��һ��ʱ�����CH2ClCHClCH3�IJ������¶ȵĹ�ϵ��ͼ1��ʾ��
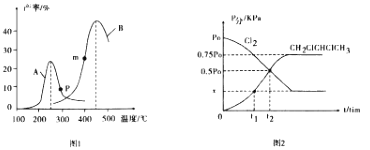
������˵����ȷ����______������ţ���
a .ʹ�ô���A��B������¶ȣ�A <B
b .p��m��ֱ��Ƕ�Ӧ�¶���CH2ClCHClCH3��ƽ�����
c. ʹ�ô��������˷�Ӧ�Ļ�ܺ��ʱ�
d. �¶Ȳ��䣬����ѹǿ��ʹCH2ClCHClCH3�IJ������
����250���Ժ�A�����в����½���ԭ�������________��д����������
��3��T��ʱʹ��ѡ���Ը��ߵĴ������ں����ܱ������ڳ�������ʵ�����C12 �� g�� ��CH2=CHCH3 ��g�����з�Ӧi�������������ֵķ�ѹǿ��p��=p���������������ʱ��ı仯��ϵ��ͼ2��ʾ���ش��������⣺
�����õ�λʱ���������ѹ�ı仯����ʾ��Ӧ���ʣ�����= ![]() ����t1~t2ʱ�����ƽ����Ӧ��������CH2=CHCH3��= _______ kPamin-1���������ĸ��ʾ����ƽ��ʱCH2ClCHClCH3���������________��
����t1~t2ʱ�����ƽ����Ӧ��������CH2=CHCH3��= _______ kPamin-1���������ĸ��ʾ����ƽ��ʱCH2ClCHClCH3���������________��
�ڷ�Ӧ��ƽ�ⳣ��KP=_____________����ƽ���ѹ����ƽ��Ũ�ȣ������ĸ��ʾ�������
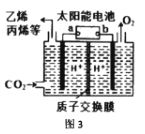
��4����ͼ3�������Ե������Һ�У��ö��Ե缫��CO2ת��Ϊ��̼ϩ���ĵ绯ѧװ�ã��ش��������⣺
��̫���ܵ�صĸ����� __________������a������b������
�����ɱ�ϩ�ĵ缫��Ӧʽ��____________��
����ͬʱ���ڣ���ͬ�����£����ĵ�CO2�����ɵ�O2 �����֮��Ϊ_________��
���𰸡�164 ad ���ȷ�Ӧ�¶�����ƽ�����ơ�����ʧȥ���� ![]() 60��
60�� ![]() a 3CO2 + 18H+ +18e- �� CH3CH=CH2 + 6H2O 2 ��3
a 3CO2 + 18H+ +18e- �� CH3CH=CH2 + 6H2O 2 ��3
��������
��1�����ø�˹���ɡ���ϻ�ܼ��㣻
��2������ͼ�����������Ի�ѧƽ���ƶ���Ӱ���������
��3�����ͼ����ʼ��ת����ƽ��֮��Ĺ�ϵ�������㣻
��4�����ݵ��ԭ���������㣻
��1��i .CH2 =CHCH3��g�� +C12��g��CH2ClCHClCH3��g�� ��H1=-134kJ��mol-1
ii . CH2 =CHCH3��g�� +C12��g��CH2=CHCH2Cl��g�� +HCl��g�� ��H2 =-102kJ��mol-1
���ݸ�˹���ɣ���i-ii��CH2=CHCH2Cl��g�� +HCl��g�� CH2ClCHClCH3��g��H=-134kJ��mol-1-��-102kJ��mol-1��=-32kJ/mol��CH2 =CHCH2Cl ��g�� + HCl �� g��CH2ClCHClCH3��g��������Ӧ�Ļ��Ea������Ϊ132 kJmol-1�����淴Ӧ�Ļ��Ea���棩Ϊ132kJ/mol+32kJ/mol=164kJ/mol��
��2����a.����ͼ��ʹ��A����250��ʱCH2ClCHClCH3�IJ������ʹ��B����450��ʱCH2ClCHClCH3�IJ������ʹ�ô���A��B������¶ȣ�A <B��a��ȷ��
b.�÷�Ӧ������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���CH2ClCHClCH3��ƽ���������p��m���Ӧ�¶���CH2ClCHClCH3�IJ��ʵ���B������450��ʱCH2ClCHClCH3�IJ��ʣ���p��m�㲻�Ƕ�Ӧ�¶���CH2ClCHClCH3��ƽ����ʣ�b����
c. ʹ�ô����ܽ��ͷ�Ӧ�Ļ�ܣ������ı��ʱ䣬c����
d. �¶Ȳ��䣬����ѹǿƽ�������ƶ�����ʹCH2ClCHClCH3�IJ�����ߣ�d��ȷ��
��ѡad��
����250���Ժ�A�����в����½���ԭ������ǣ����ȷ�Ӧ�¶�����ƽ�����ơ�����ʧȥ���Է�Ӧ���ʼ�����
��3��������ʼʱCl2��CH2=CHCH3���ʵ�����Ϊamol������ͼ����ʼʱCl2��CH2=CHCH3�ķ�ѹ��ΪP0��ƽ��ʱCH2ClCHClCH3�ķ�ѹΪ0.75P0�����º���ʱ�����ѹǿ֮�ȵ����������ʵ���֮�ȣ���ƽ��ʱCH2ClCHClCH3�����ʵ���Ϊ0.75amol�����ݷ�ӦCH2 =CHCH3��g�� +C12��g��CH2ClCHClCH3��g����֪��ƽ��ʱCl2��CH2=CHCH3���ʵ�����Ϊ0.25amol����ƽ��ʱCl2��CH2=CHCH3�ķ�ѹ��Ϊ0.25P0�����ͼ��֪��t1ʱCH2ClCHClCH3�ķ�ѹΪ0.25P0������ʼ~t1����CH2ClCHClCH3�����ʵ���Ϊ0.25amol����t1ʱCl2��CH2=CHCH3���ʵ�����Ϊ0.75amol��Cl2��CH2=CHCH3�ķ�ѹ��Ϊ0.75P0��t1~t2ʱ�����ƽ����Ӧ��������CH2=CHCH3��=![]() =
=![]() =
=![]() kPamin-1��ƽ��ʱCH2ClCHClCH3���������Ϊ
kPamin-1��ƽ��ʱCH2ClCHClCH3���������Ϊ![]() ��100%=60%��
��100%=60%��
�ڷ�Ӧ��ƽ�ⳣ��KP=![]() =
=![]() ��
��
��4����CO2ת��Ϊ��ϩ����ϩ���ǵõ��ӵĻ�ԭ���̣�Ӧ�ڵ��ص�������������̫���ܵ�صĸ���Ϊa��
��CO2��CԪ�صĻ��ϼ�Ϊ+4�ۣ�CH2=CHCH3��CԪ�ص�ƽ�����ϼ�Ϊ-2�ۣ���3molCO2�õ�18mol��������1mol CH2=CHCH3���缫��ӦʽΪ3CO2 + 18H+ +18e- ��CH3CH=CH2 + 6H2O��
�������缫��ӦʽΪ2H2O-4e-=O2��+4H+����̼ϩ����CԪ�ص�ƽ�����ϼ۶�Ϊ-2�ۣ���1molCO2ת��Ϊ��̼ϩ��ʱ���õ�6mol���ӣ����ݵ����غ㣬��ͬʱ���ڣ���ͬ�����£����ĵ�CO2�����ɵ�O2 �����֮��Ϊ4:6=2:3��

����Ŀ����ʽ�����[Cr��OH��SO4nH2O]����������Ƥ�Ⱦ�Ϲ�ҵ�Ļ��Ժ�Ⱦ�ϡ�ýȾ������Ʒ�ˮ�У���Ҫ��Cr2O72-��Cr3+��Fe3+��CN-��Cl-������Mg2+��Cu2+�����ӣ�����ȡ������ˮ�еĸ����Ƴɿ��õļ�ʽ���������Ⱦ������ҵ��������ʮ����Ҫ�����塣
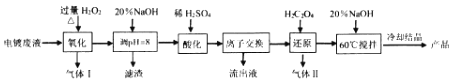
��ؽ�������[co ��Mn+��= 01 molL-1]�γ��������������pH��Χ���£�
�������� | Cr3+ | Fe3+ | Mg2+ | Cu2+ |
��ʼ������pH | 4.3 | 1.9 | 9.1 | 4.7 |
������ȫ��pH | 5.6 | 3.2 | 11.1 | 6.7 |
�ش��������⣺
��1����ʽ�������Cr�Ļ��ϼ�Ϊ_________��
��2����������ʱ����Ʒ�Ӧ�¶���50��~90�棬ԭ��___________��H2O2�Ƚ�CN-����Ϊ�������ȥ������I�ɷ���________�����ڼ��������½�Cr3+ ����ΪCrO42-����������Ҫ��________ ����������ʵĻ�ѧʽ����
��3�����ữ��ʱCrO42-��ת��ΪCr2O72-�������ӷ���ʽΪ________��
��4�������ӽ��������̲��������ӽ�����֬����Ӧԭ��ΪMn+ +nNaR=MRn+nNa+ �����������ӽ�����֬�ϵĽ�����������_________�������ӷ��ţ���
��5������1L0.1molL-1Cr2O72- �ķ�ˮ����������ҪH2C2O4�����ʵ���Ϊ_______ mol��
��6����ˮ�к��е�Cl-����K2CrO4��ҺΪָʾ������AgNO3����Һ�ζ����京��������Ag+��CrO42-���ɵ�ש��ɫ����ָʾ����ζ��յ㡣����Һ��Cl- ǡ����ȫ������Ũ�ȵ���1.0��10һ5molL-1��ʱ����Һ��c ��Ag+��Ϊ_____molL-1 ��ʱ��Һ��c��CrO42-������_______mo1L-1����֪Ag2CrO4��AgCl��Ksp�ֱ�ԼΪ2.0��10-12�ͺ�2.0��10 -10����