题目内容
【题目】某实验小组利用如下装置(部分固定装置略)制备氮化钙(CaxN2)并探究其实验式。

(1)按图连接好实验装置。检查装置的气密性,方法是_____________。
(2)反应过程中末端导管必须插入试管A的水中,目的是________________。
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后,__________;④拆除装置,取出产物。
(4)数据记录如下:
空瓷舟质量 m0/g | 瓷舟与钙的质量 m1/g | 瓷舟与产物的质景 m2/g |
14.80 | 15.08 | 15.15 |
① 计算得到实验式CaxN2,其中x=______________。
② 若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:________________。
【答案】(1)关闭活塞K,微热反应管,试管A中有气泡冒出,停止加热;冷却后若末端导管中水柱上升且高度保持不变,则说明装置气密性良好(2分)
(2)防止反应过程中空气进入反应管;便于观察N2的流速(2分)
(3)熄灭酒精灯,待反应管冷却至室温,停止通入N2,并关闭活塞K(2分)
(4)①2.80(2分)②O2和N2分别与等量的Ca反应,生成CaO的质量高于Ca3N2。若通入的N2中混有少量的O2,会导致计算出n(N)偏大,所以n(Ca)/n(N)<3/2,即x<3(2分)
【解析】
试题分析:(1)根据装置特点可知检验气密性的方法是:关闭活塞K,微热反应管,试管A中有气泡冒出,停止加热。冷却后若末端导管中水柱上升且高度保持不变,则说明装置气密性良好;
(2)为了便于观察N2的流速,同时防止反应过程中空气进入反应管,反应过程中末端导管必须插入试管A的水中;
(3)反应结束后要先熄灭酒精灯,待反应管冷却至室温,停止通入N2,并关闭活塞K;
(4)①m(Ca)=(15.08-14.80)g=0.28g,m(N)=(15.15-15.08)g=0.07g,
则n(Ca):n(N)=0.28/40:0.07/14=7:5,则x=14/5=2.8;
②由于O2和N2分别与等量的Ca反应,生成CaO的质量高于Ca3N2,因此若通入的N2中混有少量的O2,会导致计算出n(N)偏大,所以n(Ca)/n(N)<3/2,即x<3.

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】某学生用0.20mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)若移取20.00mL待测液注入有水的锥形瓶中,会导致结果(填“偏大”、“偏小”或“无影响”) 。
(3)判断滴定终点的现象是: 。
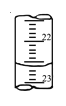
(4)如图是某次滴定时的滴定管中的液面,其读数为 mL。
(5)根据下列数据:
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 0.00 | 22.60 |
第三次 | 20.00 | 4.00 | 24.00 |
请计算待测盐酸溶液的浓度: mol/L。

