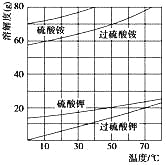
题目内容
【题目】下列实验操作中有错误的是
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 用洁净干燥的玻璃棒蘸取盐酸滴在pH试纸上,读数为3.2
C. 蒸馏操作时,温度计应该插入到液体内部以测量温度
D. 蒸发操作时,不能加热至水分完全蒸干
【答案】BC
【解析】试题分析:A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出,正确;B.用洁净干燥的玻璃棒蘸取盐酸滴在pH试纸上,读数不可能为3.2,只能为整数,错误;C.蒸馏操作时,温度计应该放在蒸馏烧瓶支管口,错误;D.蒸发操作时,应该加热到有大量晶体析出时,停止加热,用余热烘干,不能加热至水分完全蒸干,正确;故选BC。

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
【题目】某实验小组利用如下装置(部分固定装置略)制备氮化钙(CaxN2)并探究其实验式。
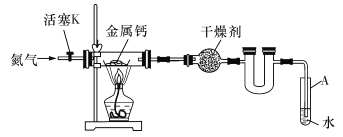
(1)按图连接好实验装置。检查装置的气密性,方法是_____________。
(2)反应过程中末端导管必须插入试管A的水中,目的是________________。
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后,__________;④拆除装置,取出产物。
(4)数据记录如下:
空瓷舟质量 m0/g | 瓷舟与钙的质量 m1/g | 瓷舟与产物的质景 m2/g |
14.80 | 15.08 | 15.15 |
① 计算得到实验式CaxN2,其中x=______________。
② 若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:________________。