题目内容
【题目】某学生用0.20mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)若移取20.00mL待测液注入有水的锥形瓶中,会导致结果(填“偏大”、“偏小”或“无影响”) 。
(3)判断滴定终点的现象是: 。
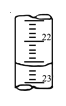
(4)如图是某次滴定时的滴定管中的液面,其读数为 mL。
(5)根据下列数据:
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 0.00 | 22.60 |
第三次 | 20.00 | 4.00 | 24.00 |
请计算待测盐酸溶液的浓度: mol/L。
【答案】(1)①、偏大;(2)无影响;
(3)最后一滴NaOH溶液加入后出现粉红色,保持30秒不消失;
(4)22.60 mL(5)0.2 mol·L-1
【解析】试题分析:(1)碱式滴定管应该是先用蒸馏水润洗,然后用标准NaOH溶液润洗,否则会影响标准液的浓度,故第①步错误;碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)= c(标准) V(标准) /V(待测)可知,测定c(待测)偏大。
(2)若移取20.00mL待测液注入有水的锥形瓶中,不影响未知浓度盐酸中HCl的物质的量,对测定结果无影响。
(3)滴定终点的现象是最后一滴NaOH溶液加入后出现粉红色,保持30秒不消失。
(4)图示滴定管中的液面读数为22.60mL。
(5)分析表中数据知第二次实验数据误差较大,舍去。取第一次和第三次实验数据的平均值,消耗标准NaOH溶液的体积为20.00mL,c(HCl)=" c(NaOH)" V[NaOH(aq) ]/V[HCl(aq) ] =(0.2 mol·L-1×20.00mL)÷20.00mL="0.2" mol·L-1。

【题目】某实验小组利用如下装置(部分固定装置略)制备氮化钙(CaxN2)并探究其实验式。
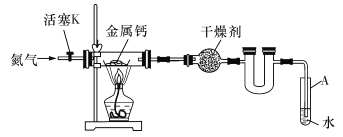
(1)按图连接好实验装置。检查装置的气密性,方法是_____________。
(2)反应过程中末端导管必须插入试管A的水中,目的是________________。
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后,__________;④拆除装置,取出产物。
(4)数据记录如下:
空瓷舟质量 m0/g | 瓷舟与钙的质量 m1/g | 瓷舟与产物的质景 m2/g |
14.80 | 15.08 | 15.15 |
① 计算得到实验式CaxN2,其中x=______________。
② 若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:________________。
【题目】该同学用如下装置进行实验,分析影响反应速率的因素:
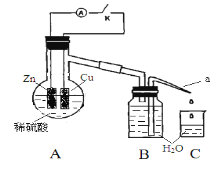
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1分钟内从a管流出的水滴数,得到的水滴数如下表所示。下列说法不正确的是
实验Ⅰ(断开K)1分钟水滴数 | 34 | 59 | 86 | 117 | … | 102 |
实验Ⅱ(闭合K))1分钟水滴数 | 58 | 81 | 112 | 139 | … | 78 |
A. 实验Ⅰ中化学能主要转化为热能
B. 实验Ⅱ中化学能主要转化为电能
C. 反应前期水滴数58>34、81>59,主要原因是实验Ⅱ中形成原电池加快反应速率
D. 反应后期水滴数102>78,主要原因是实验Ⅰ溶液温度高于实验Ⅱ