题目内容
18.将一块去掉氧化膜的锌片放入100mL pH为1的盐酸中,2min后溶液的pH变为2,则产生H2的速率可表示为(设溶液体积不变)( )| A. | 0.0225 mol/(L•min) | B. | 0.05 mol/(L•min) | ||
| C. | 0.045 mol/(L•min) | D. | 0.01 mol/(L•min) |
分析 根据锌片和盐酸的反应方程式以及反应速率公式v=$\frac{△c}{△t}$来计算.
解答 解:100mL pH为1的盐酸中,2min后溶液的pH变为2,则消耗的氢离子的浓度c=0.1mol/L-0.01mol/L=0.09mol/L,由Zn+2HCl=ZnCl2+H2↑得,在前2min 内用HCl表示的平均反应速率v(HCl)=$\frac{△c}{△t}$=$\frac{0.09mol/L}{2min}$=0.045mol•L-1•min-1,
又反应速率之比等于系数之比,所以v(H2)=$\frac{1}{2}$v(HCl)=$\frac{1}{2}$×0.045mol•L-1•min-1=0.0225mol•L-1•min-1.
故选:A.
点评 本题考查学生化学反应速率的计算公式的应用,可以根据所学知识来回答,较简单.

练习册系列答案
相关题目
13.下列有关实验的选项正确的是( )
| A.配制0.10mol•L-1NaOH溶液 | B.除去CO中的CO2 | C.苯萃取碘水中I2,分出水层后的操作 | D.记录滴定终点读数为12.20mL |
 | 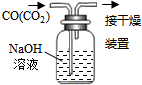 |  | 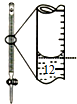 |
| A. | A | B. | B | C. | C | D. | D |
9.对反应A+3B?2C来说,下列反应速率中最快的是( )
| A. | V(B)=0.6 mol/(L•min) | B. | V(A)=0.3 mol/(L•min) | ||
| C. | V(B)=0.02/(L•S) | D. | V(C)=0.5 mol/(L•min) |
13.一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g),达到平衡后测得A气体的浓度为0.5mol/L;当恒温下将密闭容器的容积扩大一倍并再次达到平衡时,测得A的浓度为0.3mol/L.则下列叙述正确的是( )
| A. | 平衡向正反应方向移动 | B. | x+y>z | ||
| C. | B的转化率提高 | D. | C的体积分数增加 |
7.下列叙述正确的是( )
| A. | 含有5个碳原子的烷烃,每个分子中最多可形成5个C-C单键 | |
| B. | 正丁烷中四个碳原子在同一条直线上 | |
| C. | 所有烷烃中都存在碳碳单键 | |
| D. | 二氯甲烷只有一种结构 |
8.碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图,下列有关该物质的说法正确的是( )
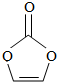

| A. | 分子式为C3H2O3 | B. | 分子中含6个σ键 | ||
| C. | 分子中只有极性键 | D. | 8.6g该物质完全燃烧得到6.72LCO2 |

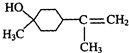 ;γ松油醇:
;γ松油醇: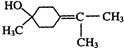 .
.