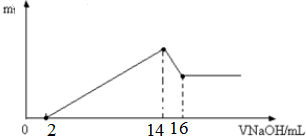
题目内容
10.水垢中可能含有CaCO3、MgCO3、Mg(OH)2,某学生为了测定水垢的组成,做了如下实验:(1)取2.90g水垢样品,加入40mL盐酸,为保证固体全部溶解,并使二氧化碳全部逸出,盐酸的物质的量浓度≥2.5mol/L;
(2)另取2.89g水垢高温灼烧至恒重,残余固体为CaO和MgO,其质量为1.48g,产生的气体被足量的澄清石灰水吸收,得到0.03molCaCO3沉淀,则原水垢中一定含有MgCO3,理由是假定都是碳酸钙,生成1.32克CO2,需要碳酸钙的质量=$\frac{1.32}{44}×100$=3g,而质量只有2.89g,所以有碳酸镁和氢氧化镁;通过计算确定是否含有Mg(OH)2?
(3)水垢中CaCO3的质量分数?
分析 (1)相对分子质量:CaCO3是100、MgCO3是84、Mg(OH)2是58,三都中碳酸钙的分子量最大,也就是如果2.9克固体全部碳酸钙时,物质的量最少消耗的盐酸的物质的量也最小,由关系式:
CaCO3~2HCl
1 2
$\frac{2.9}{100}$ $\frac{2.9}{50}$mol
,而为保证固体全部溶解,所以氢氧化镁消耗酸的能力最强,如果2.9克固体全部氢氧化镁时,全然后求盐酸的物质的量浓度的最小值,然后根据两个最小值,综合分析;
(2)得到0.03 mol CaCO3沉淀,需要CO2的质量=0.03×44=1.32g,则生成水的质量=2.89-1.48-1.32=0.09克
氢氧化镁的质量=$\frac{0.09}{18}×58$=0.29克
则碳酸盐的质量=2.89-0.29=2.6克
假定都是碳酸钙,生成1.32克CO2,需要碳酸钙的质量=$\frac{1.32}{44}×100$=3g,与原始质量相比得出结论;
(3)设有碳酸钙X克,能生成CO2Y克,最后求出水垢中CaCO3的质量分数.
解答 解:(1)相对分子质量:CaCO3是100、MgCO3是84、Mg(OH)2是58,三都中碳酸钙的分子量最大,也就是如果2.9克固体全部碳酸钙时,物质的量最少消耗的盐酸的物质的量也最小,由关系式:
CaCO3~2HCl
1 2
$\frac{2.9}{100}$ $\frac{2.9}{50}$mol
所以盐酸的物质的量浓度大于$\frac{\frac{2.9}{50}}{0.04}$=1.45mol/L,
而为保证固体全部溶解,所以氢氧化镁消耗酸的能力最强,如果2.9克固体全部氢氧化镁时,
Mg(OH)2~2HCl
58g 2mol
2.9g 0.1mol,
所以盐酸的物质的量浓度大于$\frac{0.1}{0.04}$=2.5mol/L,综上所述为保证固体全部溶解,并使二氧化碳全部逸出,盐酸的浓度应大于2.5mol/L,
故答案为:2.5;
(2)得到0.03 mol CaCO3沉淀,需要CO2的质量=0.03×44=1.32g,则生成水的质量=2.89-1.48-1.32=0.09克
氢氧化镁的质量=$\frac{0.09}{18}×58$=0.29克
则碳酸盐的质量=2.89-0.29=2.6克
假定都是碳酸钙,生成1.32克CO2,需要碳酸钙的质量=$\frac{1.32}{44}×100$=3g,所以有碳酸镁和氢氧化镁,故答案为:假定都是碳酸钙,生成1.32克CO2,需要碳酸钙的质量=$\frac{1.32}{44}×100$=3g,而质量只有2.89g,所以有碳酸镁和氢氧化镁;
(3)设有碳酸钙X克,能生成CO2Y克
则有碳酸镁2.6-X,能生成CO21.32-Y
CaCO3~~~~~CO2
100 44
X Y
44X=100Y
MgCO3~~~~~CO2
84 44
2.6-X 1.32-Y
44×(2.6-X)=84×(1.32-Y)
解得
X=0.5克
水垢中CaCO3的质量分数为$\frac{0.5}{2.89}×100%$=17.3%,答:水垢中CaCO3的质量分数为17.3%..
点评 本题考查了混合组成的分析判断的有关计算,明确物质之间的反应结合方程式来分析解答,注意根据反应方程式及结合关系式进行计算,题目难度较大.

| A. | 0.0225 mol/(L•min) | B. | 0.05 mol/(L•min) | ||
| C. | 0.045 mol/(L•min) | D. | 0.01 mol/(L•min) |
| 溶液的物质的量浓度/mol•L-1 | 电离度/% | H+的物质的量浓度/mol•L-1 | pH |
| 0.1 | 2α | c1 | x |
| c | α | 2c1 | 3 |
| A. | 14g | B. | 47g | C. | 54g | D. | 94g |
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=-99kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=+41kJ.mol-1
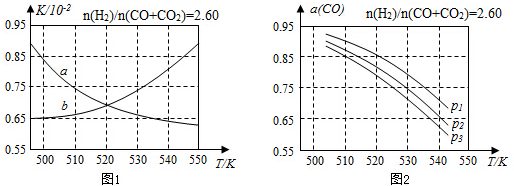
(2)反应①的化学平衡常数K的表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母),其判断理由是反应①正反应为放热反应,平衡常数随温度升高而减小.
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示.a(CO)值随温度升高而减小(填“增大”或“减小”),其原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小.图2中的压强由大到小为P1>P2>P3,其判断理由是相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高

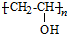 、CH3CH2CH2CHO.
、CH3CH2CH2CHO. .
.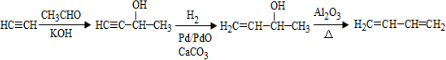 .
.
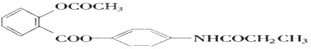 ,当它完全水解时,得到4种有机产物,它们的结构简式分别为
,当它完全水解时,得到4种有机产物,它们的结构简式分别为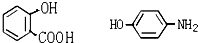 、CH3COOH、CH3CH2OH.
、CH3COOH、CH3CH2OH.