题目内容
8.碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图,下列有关该物质的说法正确的是( )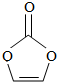
| A. | 分子式为C3H2O3 | B. | 分子中含6个σ键 | ||
| C. | 分子中只有极性键 | D. | 8.6g该物质完全燃烧得到6.72LCO2 |
分析 A、 为有机物的结构简式,其中顶点省略的是C原子,每个C原子均形成4对共价键,每个O原子形成2对共价键,C原子价键不饱和的用H原子补充,据此判断分子式;
为有机物的结构简式,其中顶点省略的是C原子,每个C原子均形成4对共价键,每个O原子形成2对共价键,C原子价键不饱和的用H原子补充,据此判断分子式;
B、单键即为σ键,依据此结构简式判断σ键的个数;
C、相同原子之间形成非极性共价键,不同原子之间形成极性共价键,据此解答;
D、依据C的完全燃烧产物为二氧化碳,依据此有机物物质的量判断标准状况下生成二氧化碳的体积.
解答 解:A、 ,此有机物中含有3个C、3个O和2个H,故分子式为:C3H2O3,故A正确;
,此有机物中含有3个C、3个O和2个H,故分子式为:C3H2O3,故A正确;
B、此分子中存在4个C-O键、1个C=O双键,还存在2个C-H键,1个C=C双键,总共8个σ键,故B错误;
C、此有机物中存在C=C键,属于非极性共价键,故C错误;
D、8.6g该有机物的物质的量为:$\frac{8.6g}{86g/mol}$=0.1mol,由于未指明标准状况,故生成的二氧化碳的体积不一定是6.72L,故D错误,
故选A.
点评 本题主要考查的是有机物结构简式的判断,涉及分子式书写、化学键类型判断、有机物的燃烧等,综合性较强,但是难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
18.将一块去掉氧化膜的锌片放入100mL pH为1的盐酸中,2min后溶液的pH变为2,则产生H2的速率可表示为(设溶液体积不变)( )
| A. | 0.0225 mol/(L•min) | B. | 0.05 mol/(L•min) | ||
| C. | 0.045 mol/(L•min) | D. | 0.01 mol/(L•min) |
16.下列物质中,在一定条件下既能跟乙醇反应,又能跟乙酸反应的是( )
| A. | Cu | B. | CuO | C. | CaCO3 | D. | NaHCO3 |
3.甲~庚等元素在周期表中的相对位置如表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,下列判断正确的是( )
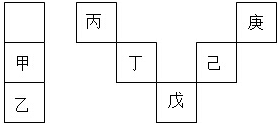

| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,甲和乙的单质均能与水剧烈反应 | |
| D. | 丁的最高价氧化物可用于制造光导纤维 |
20.甲醇既是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1=-99kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=+41kJ.mol-1
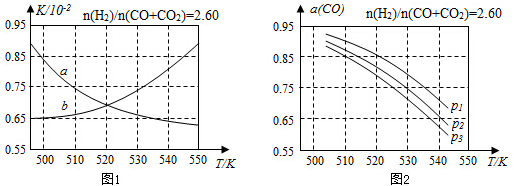
(2)反应①的化学平衡常数K的表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母),其判断理由是反应①正反应为放热反应,平衡常数随温度升高而减小.
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示.a(CO)值随温度升高而减小(填“增大”或“减小”),其原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小.图2中的压强由大到小为P1>P2>P3,其判断理由是相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=-99kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=+41kJ.mol-1
(2)反应①的化学平衡常数K的表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母),其判断理由是反应①正反应为放热反应,平衡常数随温度升高而减小.
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示.a(CO)值随温度升高而减小(填“增大”或“减小”),其原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小.图2中的压强由大到小为P1>P2>P3,其判断理由是相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高

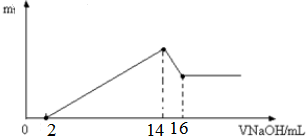
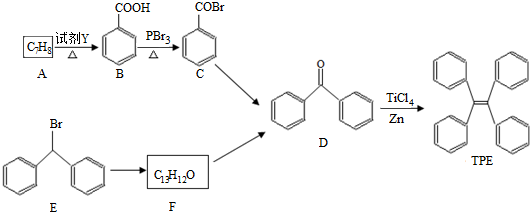
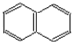
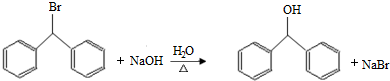 ;
; )的一元取代物;②存在羟甲基(-CH2OH),写出W所有可能的结构简式:
)的一元取代物;②存在羟甲基(-CH2OH),写出W所有可能的结构简式: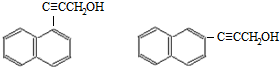 ;
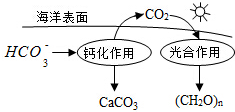
;
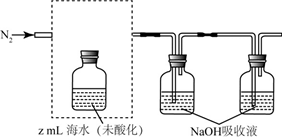
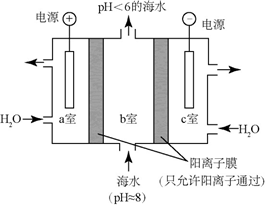
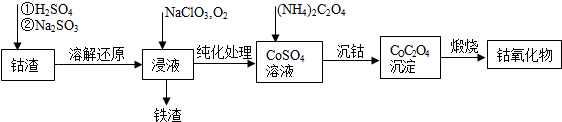
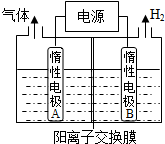 利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.
利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.