题目内容
3.在200mL氢氧化钡溶液中含有1×10-3mol的钡离子,溶液的pH为12.将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是1:10.分析 根据在Ba(OH)2溶液中,Ba2+和OH-的物质的量之比为1:2,求出OH-的物质的量,然后根据C=$\frac{n}{V}$求出OH-的物质的量浓度,然后根据水的离子积求出C(H+),从而求出pH;
设出Ba(OH)2溶液的体积为V1,盐酸溶液的体积为V2,根据混合后溶液显中性,则n(H+)=n(OH-),据此计算.
解答 解:在Ba(OH)2溶液中,Ba2+和OH-的物质的量之比为1:2,故n(OH-)=2n(Ba2+)=2×10-3mol,故溶液中C(OH-)=$\frac{n}{V}$=$\frac{2×1{0}^{-3}mol}{0.2L}$=0.01mol/L,则C(H+)=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L,故pH=-lgC(H+)=12;
设Ba(OH)2溶液的体积为V1,盐酸溶液的体积为V2,根据混合后溶液显中性,则n(OH-)=n(H+),即0.01mol/L×V1=0.001mol/L×V2,解得$\frac{{V}_{1}}{{V}_{2}}$=$\frac{1}{10}$.
故答案为:12;1:10.
点评 本题考查了溶液pH的有关计算,应注意的是溶液的pH=-lgC(H+),难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
18.分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有(不含量立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
14.下列关于元素周期表的说法不正确的是( )
| A. | 除零族元素外,非金属元素全部都是主族元素 | |
| B. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| C. | 同周期ⅡA族与ⅢA族元素的原子序数之差可能为25 | |
| D. | 同族上下相邻两种元素的原子序数之差可能为32 |
18.将一块去掉氧化膜的锌片放入100mL pH为1的盐酸中,2min后溶液的pH变为2,则产生H2的速率可表示为(设溶液体积不变)( )
| A. | 0.0225 mol/(L•min) | B. | 0.05 mol/(L•min) | ||
| C. | 0.045 mol/(L•min) | D. | 0.01 mol/(L•min) |
8.向1L某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L.反应过程中溶液的体积变化忽略不计,则下列说法中正确的是( )
| A. | 原溶液的浓度约为0.13mol/L | B. | 反应后溶液中c(Fe3+)=0.1mol/L | ||
| C. | 反应后溶液中c(Fe3+)=c(Fe2+) | D. | 原溶液中c(Br-)=0.4mol/L |
12.将1.800g FeC2O4•2H2O固体放在一个可称量的容器中加热,分解产物为CO、CO2、H2O与铁的氧化物,已知500℃时残留固体质量为0.800g,则此时所得气体的平均摩尔质量为( )
| A. | 25g/mol | B. | 27g/mol | C. | 30g/mol | D. | 32g/mol |
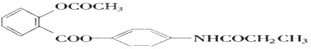 ,当它完全水解时,得到4种有机产物,它们的结构简式分别为
,当它完全水解时,得到4种有机产物,它们的结构简式分别为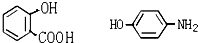 、CH3COOH、CH3CH2OH.
、CH3COOH、CH3CH2OH.
 ;
; )的一元取代物;②存在羟甲基(-CH2OH),写出W所有可能的结构简式:
)的一元取代物;②存在羟甲基(-CH2OH),写出W所有可能的结构简式: ;
;