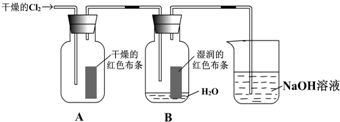
题目内容
6.2008年北京奥运会的“祥云”火炬所用燃料的主要成分是丙烷,下列有关丙烷的叙述正确的是( )| A. | 丙烷的分子式是C3H6 | |
| B. | 丙烷分子中的碳原子在一条直线上 | |
| C. | 丙烷在光照条件下能够发生取代反应 | |
| D. | 丙烷的熔点比乙烷低 |
分析 A.根据烷烃的通式判断丙烷的分子式;
B.根据甲烷的结构判断丙烷的结构;
C.根据烷烃的性质分析判断;
D.烷烃和烯烃的物理性质随着分子中碳原子数的递增呈规律性变化,沸点逐渐升高;碳原子数相同的烃,支链越多,熔沸点越低.
解答 解:A.烷烃的通式为CnH2n+2,丙烷中的碳原子数是3,所以丙烷的分子式为C3H8,故A错误;
B.甲烷是正四面体结构,所有的原子都不在一条直线上,丙烷相当于甲烷中的两个氢原子被两个甲基取代,所以丙烷分子中的碳原子不在一条直线上,故B错误;
C.烷烃能和氯气发生取代反应生成氯代烃,所以丙烷在光照条件下能够发生取代反应,故C正确;
D.烷烃和烯烃的物理性质随着分子中碳原子数的递增呈规律性变化,沸点逐渐升高,丙烷的碳原子数大于乙烷的,所以丙烷的沸点大于乙烷的,故D错误;
故选C.
点评 本题考查了丙烷的结构和性质,易错选项是B,注意根据甲烷的结构类比丙烷来分析即可,题目难度不大.

练习册系列答案
相关题目
16.人的体味中存在两种名为AND和EST的荷尔蒙,结构如图所示.下列说法不正确的是( )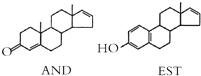

| A. | AND和EST都能使酸性 KMnO4溶液褪色 | |
| B. | AND和EST两者的相对分子质量之差为14 | |
| C. | AND和EST分别与足量氢气加成后的两种生成物互为同系物 | |
| D. | AND和EST与溴水完全反应消耗溴单质的物质的量之比为2:3 |
17.恒温下,在容积不变的密闭容器中将N2和H2混合,使其在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),并达到化学平衡,根据表中数据回答有关问题
(1)表中a=2.5,e=1.5
(2)若反应经3min达到平衡,则反应速率v(N2)=0.5mol•L-1•min-1;
(3)该反应体系的起始状态与平衡状态的压强之比为17:11;
(4)上述反应过程中,如果降低温度,则反应速度减小(填“增大”或“减小”“不变”).
(5)下列各项中,可以说明上述反应达到平衡的是BCD(填序号)
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2的正反应速率等于逆反应速率
D.N2的浓度保持恒定不变.
| 物质的量浓度 | N2 | H2 | NH3 |
| 起始/mol•L-1 | a | 6 | 0 |
| 转化/mol•L-1 | b | c | d |
| 平衡/mol•L-1 | 1 | e | 3 |
(2)若反应经3min达到平衡,则反应速率v(N2)=0.5mol•L-1•min-1;
(3)该反应体系的起始状态与平衡状态的压强之比为17:11;
(4)上述反应过程中,如果降低温度,则反应速度减小(填“增大”或“减小”“不变”).
(5)下列各项中,可以说明上述反应达到平衡的是BCD(填序号)
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2的正反应速率等于逆反应速率
D.N2的浓度保持恒定不变.
14.下列说法不正确的是( )
| A. | HCl、HBr、HI的熔点沸点升高与范德华力大小有关 | |
| B. | H2O的熔点沸点大于H2S的是由于H2O分子之间存在氢键 | |
| C. | 乙醇与水互溶可以用相似相溶原理解释 | |
| D. | 甲烷与水分子间不能形成氢键这种化学键 |
1.金融危机之下,中国铝工业受到了巨大的冲击.2009年6月30日至7月2日在上海新国际博览中心举办的中国国际铝工业展览会却提出了“展现铝业盎然生机”的口号,成为全球铝业的焦点和亮点.某化学兴趣小组的同学们决定铝及其化合物的性质比较展开探究活动.搜索到的一些实验数据如下:
铝及其氧化物的有关实验数据如下:
(1)将铝片插入硝酸汞溶液中,铝片表面灰暗,用湿布擦试后,铝片上附着了液态银白色的物质.将该铝片静置一段时间,铝片表面长出白色须状物,手持铝片时,白色须状物脱落,铝片发烫.经实验白色须状物能溶于稀盐酸且无气体放出.试写出直接导致铝片发烫的热化学反应方程式4Al(s)+3O2(g)=2Al2O3(s),△H=-2408KJ/mol.
(2)剪长约6cm、宽2cm的铜片、铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2cm).将铜片与铝片分别和电流表的“+”、“-”端相连接,电流表指针调到中间位置.取两个50mL的小烧杯,在一个烧杯中注入约40mL的浓硝酸,在另一只烧杯中注入40mL0.5mol/L的硫酸溶液.试回答下列问题:
①两电极同时插入稀硫酸中,电流表指针偏向铝(填“铝”或“铜”)极,铝片上电极反应式为Al-3e-=Al3+;
②两电极同时插入浓硝酸时,电流表指针偏向铜(填“铝”或“铜”)极,此时铝是正(填“正”或“负”)极,铝片上电极反应式为2NO3-+2e-+4H+=2NO2↑+2H2O.
(3)能源问题是人们关心的热点,有人提出用金属铝作燃料,这真是一种大胆而新颖的设想.对此,你的观点是B(填“A”或“B”),其理由是工业上用电解氧化铝的方法制取铝,要消耗大量的电能.A.可行B.不可行.
铝及其氧化物的有关实验数据如下:
| 熔点/℃ | 沸点/℃ | 燃烧热/kJ•mol-1 | |
| 铝 | 660 | 2467 | 602 |
| 氧化铝 | 2050 | 2980 | / |
(2)剪长约6cm、宽2cm的铜片、铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2cm).将铜片与铝片分别和电流表的“+”、“-”端相连接,电流表指针调到中间位置.取两个50mL的小烧杯,在一个烧杯中注入约40mL的浓硝酸,在另一只烧杯中注入40mL0.5mol/L的硫酸溶液.试回答下列问题:
①两电极同时插入稀硫酸中,电流表指针偏向铝(填“铝”或“铜”)极,铝片上电极反应式为Al-3e-=Al3+;
②两电极同时插入浓硝酸时,电流表指针偏向铜(填“铝”或“铜”)极,此时铝是正(填“正”或“负”)极,铝片上电极反应式为2NO3-+2e-+4H+=2NO2↑+2H2O.
(3)能源问题是人们关心的热点,有人提出用金属铝作燃料,这真是一种大胆而新颖的设想.对此,你的观点是B(填“A”或“B”),其理由是工业上用电解氧化铝的方法制取铝,要消耗大量的电能.A.可行B.不可行.
18.下列操作不合适的是( )
| A. | 银镜反应采用水浴加热 | |
| B. | 用通过盛溴水的洗气瓶的方法除去甲烷气体中含有的乙烯杂质 | |
| C. | 在乙醛还原新制Cu(OH)2悬浊液的实验中,制Cu(OH)2悬浊液时应保持NaOH过量,可直接加热 | |
| D. | 配制银氨溶液时,将AgNO3溶液滴入氨水中 |
16.现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入几滴AgNO3溶液后有沉淀产生;
(2)第二份加过量NaOH溶液加热后,只收集到气体0.03mol,无沉淀生成,同时得到溶液甲
(3)在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g
(4)第三份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.
下列说法不正确的是( )
(1)第一份加入几滴AgNO3溶液后有沉淀产生;
(2)第二份加过量NaOH溶液加热后,只收集到气体0.03mol,无沉淀生成,同时得到溶液甲
(3)在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g
(4)第三份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.
下列说法不正确的是( )
| A. | 步骤(3)后可以确定CO32-一定不存在 | |
| B. | 忽略步骤(1)对实验结论并无影响 | |
| C. | 不能确定原溶液是否含有K+和Cl- | |
| D. | 若把步骤(2)产生的气体通入步骤(1)的滤液中,又可产生0.78g沉淀 |
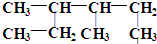 的名称为3,4-二甲基己烷,它的一氯代物有4种同分异构体.
的名称为3,4-二甲基己烷,它的一氯代物有4种同分异构体.