题目内容
【题目】(1)第二周期元素中,第一电离能介于B和O之间的元素有 。
(2)N、O可以组成微粒NO2+,它的电子式为 ,其等电子体有 (至少2种)。
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子外围电子排布式为______;
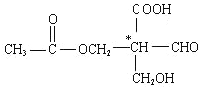
(4)某有机物结构如下图所示,其分子中的原子除H外有 个以sp3杂化,2mol该分子含有π键的数目为

(5)已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现紫色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为绿色晶体的水溶液反应得到沉淀质量的1.5倍。则绿色晶体配合物的化学式为 。(表示出内界和外界)
【答案】(1)Be;C
(2)![]() ;CO2、N2O、SCN-、OCN-、CNO- 、CS2、BeCl2等
;CO2、N2O、SCN-、OCN-、CNO- 、CS2、BeCl2等
(3)5d106s1
(4)5;12NA
(5)[Ti(H2O)5Cl]Cl2·H2O
【解析】试题分析:(1)同周期,从左向右第一电离能增大,则第二周期元素中,第一电离能介于B和O之间的元素有Be、C,故答案为:Be、C;
(2)N、O可以组成微粒NO2+,与CO2互为等电子体,结构相似,其电子式为![]() ,等电子体还有N2O、SCN-、OCN-、CNO-、CS2、BeCl2等,故答案为:
,等电子体还有N2O、SCN-、OCN-、CNO-、CS2、BeCl2等,故答案为:![]() ;N2O、CO2;
;N2O、CO2;
(3)金(Au)处于周期表中的第六周期,与Cu同族,为IB族元素,Au原子外围电子排布式为5d106s1,故答案为:5d106s1;
(4)2个甲基上C、氨基中N、-OH中O及三个环状中心的C为sp3杂化,则有5个原子以sp3杂化,双键中有1个π键,则2mol该分子含有π键的数目为12NA,故答案为:5;12NA;
(5)在配合物中的氯原子是不能自由移动的,但配离子中可以形成氯离子,氯离子可以与银离子反应生成氯化银白色沉淀,发现紫色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为绿色晶体的水溶液反应得到沉淀质量的1.5倍,说明紫色晶体中有三个自由移动的氯离子,而绿色晶体中只有2个自由移动的离子,即有一个氯原子形成了配合物,因为钛为6配位,即配合物中须有五个水,即化学式为[TiCl(H2O)5]Cl2H2O,而紫色晶体的化学式为[Ti(H2O)6]Cl3,故答案为:[Ti(H2O)5Cl]Cl2H2O。