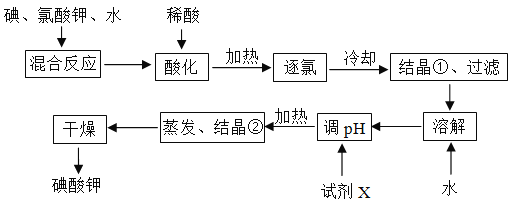
题目内容
【题目】水合肼 (N2H4·H2O) 常用作还原剂和抗氧剂,其熔点为 -40℃,沸点 118.5℃,极毒。实验室用如下装置制取水合肼(N2H4·H2O)涉及下列反应:

CO(NH2)2+ 2NaOH +NaClO = Na2CO3 + N2H4·H2O + NaCl
N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl]
请回答下列问题:
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有 (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)将Cl2通入30%NaOH溶液制备NaClO的化学方程式 。
(3)实验时,如果将 NaOH 和NaClO的混合溶液一次性加入三颈烧瓶,可能会造成的结果是__________。
(4)实验时可根据_________判断N2H4·H2O开始蒸出。
(5)已知:N2H4·H2O + 2I2= N2↑+ 4HI + H2O。测定水合肼的质量分数可采用下列步骤:
①取1.250g试样,经溶解、转移、定容等步骤,配制250mL溶液。
②移取10.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,加20mL水,摇匀。
③将0.1000mol·L-1碘的标准溶液盛放在__________滴定管中(填“酸式”或“碱式”),当_____________停止滴定,消耗碘的标准溶液为18.00mL,则产品中N2H4·H2O的质量分数为__________。
【答案】
(1)B、D;
(2)Cl2+ 2NaOH=NaClO + NaCl + H2O ;
(3)如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化;
(4)温度计1指示的温度恰为N2H4·H2O的沸点;
(5)酸式;当锥形瓶中溶液由无色变蓝色,且半分钟不褪色;90%
【解析】
试题分析:(1)用天平称量氢氧化钠质量,用量筒量取水的体积,在烧杯中溶解,并用玻璃棒搅拌,所需玻璃仪器除量筒外,还有烧杯、玻璃棒,故答案为:BD;
(2)氯气通入到盛有NaOH的锥形瓶中发生反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O;故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(3)由N2H4H2O+2NaClO=N2↑+3H2O+2NaCl,可知水合肼(N2H4H2O)具有还原性,如果将 NaOH 和 NaClO 的混合溶液一次性加入三颈烧瓶,反应生成的水合肼会被次氯酸钠氧化,故答案为:反应生成的水合肼会被次氯酸钠氧化;
(4)生成水合肼 (N2H4H2O) 进行蒸馏分离,温度计1温度为118.5℃,判断 N2H4H2O 开始蒸出,故答案为:温度计1温度为118.5℃;
(5)碘单质具有氧化性,能腐蚀碱式滴定管的橡胶,则碘水应装在酸式滴定管中;加入最后一滴碘溶液颜色不褪去,溶液呈微黄色且半分钟内不消失,说明滴定到达终点;由N2H4+2I2=N2+4HI,可知250ml溶液中含有的物质的量=0.100mol/L×0.018L×![]() ×
×![]() =0.0225mol,水合肼(N2H4H2O)的质量分数=
=0.0225mol,水合肼(N2H4H2O)的质量分数=![]() ×100%=90%,故答案为:酸式;溶液呈微黄色且半分钟内不消失;90%。
×100%=90%,故答案为:酸式;溶液呈微黄色且半分钟内不消失;90%。