题目内容
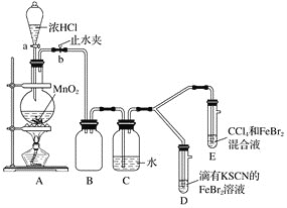
【题目】某研究小组将NaBO2SiO2和Na的固体混合物与H2在500℃条件下制备NaBH4,实验装置如图所示已知NaBH4中B为+3价,下列说法错误的是

A.装置甲还可以用于制取CO2H2S
B.装置乙丙中分别装有NaOH溶液和浓硫酸
C.管式炉加热之前应收集装置尾部气体并验纯
D.可将反应后混合物加水溶解后用重结晶法提纯
【答案】D
【解析】
盐酸与锌反应生成氢气,由于盐酸具有挥发性,制取的氢气中含有氯化氢和水蒸气,故通过装置乙中的氢氧化钠溶液除去氯化氢杂质,在通过装置丙中的浓硫酸干燥除去水蒸气,干燥的氢气通入管式炉中一段时间后,对管式炉尾部流出的气体先验纯,再对管式炉进行加热,让氢气与NaBO2SiO2和Na固体混合物在500℃条件下反应制备NaBH4,反应方程式为:NaBO2+2SiO2+4Na+2H2![]() NaBH4+2Na2SiO3,据此分析解答。
NaBH4+2Na2SiO3,据此分析解答。
A.装置甲为块状固体与液体不加热反应制气体的装置,可以看做启普发生器的简易装置,实验室用大理石或石灰石与稀盐酸反应制取二氧化碳,用硫化亚铁固体与稀盐酸或稀硫酸反应制取硫化氢,都属于块状固体与液体不加热反应制气体,装置甲可以用于制取CO2H2S,故A正确;
B.根据分析装置乙丙分别用于除去氢气中混有的氯化氢和水蒸气,NaOH溶液可与氯化氢反应,浓硫酸具有吸水性,故B正确;
C.氢气通入管式炉中与NaBO2SiO2和Na固体混合物在500℃条件下反应制备NaBH4,高温下,管式炉中若含有空气,氢气与氧气反应会引发爆炸,则管式炉加热之前应收集装置尾部气体并验纯,故C正确;
D.根据分析,管式炉中发生的反应化学方程式为:NaBO2+2SiO2+4Na+2H2![]() NaBH4+2Na2SiO3,NaBH4中B为+3价,则H为-1价,将反应后混合物加水溶解后,NaBH4可与水发生反应:NaBH4+2H2O=NaBO2+4H2↑,无法做到NaBH4提纯,故D错误;
NaBH4+2Na2SiO3,NaBH4中B为+3价,则H为-1价,将反应后混合物加水溶解后,NaBH4可与水发生反应:NaBH4+2H2O=NaBO2+4H2↑,无法做到NaBH4提纯,故D错误;
答案选D。

 阅读快车系列答案
阅读快车系列答案