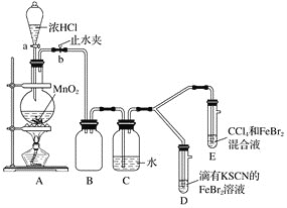
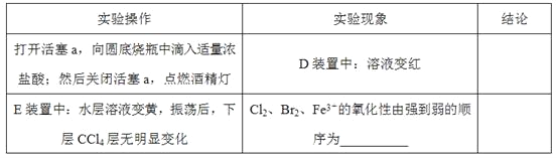
题目内容
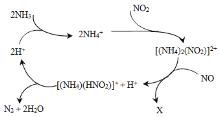
【题目】当反应L(s)+aG(g) ![]() bR(g)达到平衡后,温度和压强对该反应的影响如图所示,图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
bR(g)达到平衡后,温度和压强对该反应的影响如图所示,图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
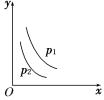
A. 上述反应是放热反应 B. 上述反应是吸热反应
C. a>b D. a<b
【答案】BD
【解析】
图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数,则相同压强下,温度越高,G的体积分数越小;相同温度时,压强越大,G的体积分数越大,以此来解答。
分析温度与G的体积分数的变化关系。
据图知,温度升高,G的体积分数降低,而G的体积分数降低,表示化学平衡向正反应方向移动,即升高温度,化学平衡向正反应方向移动。
根据化学平衡移动原理,升高温度,化学平衡向吸热反应的方向移动,则此反应的正反应为吸热反应。
分析压强与G的体积分数的变化关系。
据图知,压强增大(p1>p2),G的体积分数也增大,而G的体积分数增大,表示化学平衡向逆反应方向移动,即增大压强,化学平衡向逆反应方向移动。
根据化学平衡移动原理,增大压强,化学平衡向气体体积缩小的方向移动,则a<b。
综合以上分析,BD正确,
故答案选BD。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目