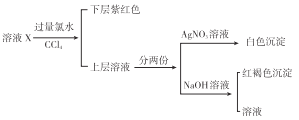
题目内容
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O,下列说法正确的是
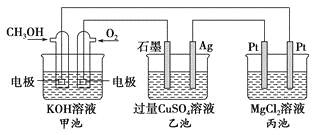
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
【答案】D
【解析】
丙池两端的电极材料相同,应作电解池;甲池是燃料电池,CH3OH中碳元素失电子,化合价升高,作负极,电极反应为CH3OH-6e-+8OH-===CO32-+6H2O;O2得电子,化合价降低,作正极,电极反应为O2+4e﹣+2H2O=4OH-。乙池石墨电极与正极相连,作阳极;Ag电极是阴极。丙池右侧Pt与负极相连,作阴极;左侧Pt是阳极。据以上分析解答。
A项,甲池是燃料电池,属于原电池,是将化学能转化为电能的装置,乙、丙池属于电解池,是将电能转化为化学能的装置,故A项错误;
B项,甲池是燃料电池,CH3OH燃料通入的极是电池的负极,发生氧化反应,因电解质是氢氧化钾,所以电极反应不会生成氢离子,故B项错误;
C项,电解硫酸铜时,阳极放氧气,阴极析出金属铜,所以要让电解质在电解后复原,应加入氧化铜,故C项错误;
D项,丙池中,电解硝酸银时,阴极析出金属银,甲池中的正极发生的电极反应为:O2+4e﹣+2H2O=4OH-,消耗280mL(标准状况下)即0.0125molO2,转移的电子为0.05mol,阴极氢离子得电子生成氢气,致使氢氧根与镁离子结合生成氢氧化镁,则丙池生成氢氧化镁的质量为58g/mol×0.025mol=1.45g,故D项正确;
综上所述,本题选D。

 名校课堂系列答案
名校课堂系列答案