题目内容
13.下列物质中属于碱性氧化物的是( )| A. | CO2 | B. | Na2O | C. | Na2O2 | D. | FeSO4 |
分析 根据碱性氧化物是能与酸反应生成盐和水的氧化物、主要包括绝大多数金属氧化物来回答.
解答 解:A、二氧化碳属于酸性氧化物,故A错误;
B、氧化钠可以和酸反应生成盐和水,属于碱性氧化物,故B正确;
C、过氧化钠和酸反应生成盐和水,还生成氧气,不属于碱性氧化物,故C错误;
D、硫酸亚铁属于盐,不属于氧化物,故D错误.
故选B.
点评 本题考查了物质的分类,需要掌握碱性氧化物的概念,题目难度不大,注意对概念的理解.

练习册系列答案
相关题目
3.在一定条件下,某化合物W受热分解:2W$\frac{\underline{\;△\;}}{\;}$A↑+2B↑+4C↑,测得反应后生成的混合气体是相同条件下等体积H2质量的11.43倍,则W的摩尔质量是( )
| A. | 11.43 | B. | 22.86g/mol | C. | 80.01 | D. | 80.01g/mol |
4. 锰(Mn)是维持人体正常生命活动所必须的微量元素,含锰化合物在生产、生活中也被广泛应用.结合图中信息,下列叙述正确的是( )
锰(Mn)是维持人体正常生命活动所必须的微量元素,含锰化合物在生产、生活中也被广泛应用.结合图中信息,下列叙述正确的是( )
 锰(Mn)是维持人体正常生命活动所必须的微量元素,含锰化合物在生产、生活中也被广泛应用.结合图中信息,下列叙述正确的是( )
锰(Mn)是维持人体正常生命活动所必须的微量元素,含锰化合物在生产、生活中也被广泛应用.结合图中信息,下列叙述正确的是( )| A. | 锰原子核内有25个质子,一个锰原子的质量是54.94g | |
| B. | 锰原子核外有4个电子层,其化学性质由最内层电子决定 | |
| C. | MnO2属于氧化物,在H2O2分解制O2的实验中做催化剂 | |
| D. | KMnO4为紫黑色固体,易溶于水、汽油等溶剂,形成紫红色溶液 |
8.下列化学用语表示正确的是( )
| A. | N2分子的电子式: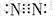 | B. | 中子数为18的氯原子的原子符号: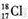 | ||
| C. | 18O2-的结构示意图: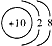 | D. | CO2的比例模型: |
18.下列物质能够使胃液酸度降低,起到中和过多胃酸作用的是( )
| A. | Na2CO3 | B. | Na2O | C. | CaO | D. | Al(OH)3 |
5.分子式为C3H6O且能使溴水褪色的有机物有( )种.
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
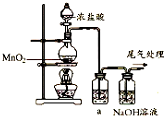 某兴趣小组的同学用如图装置制取漂白液(有效成分为NaClO),并研究其相关性质.
某兴趣小组的同学用如图装置制取漂白液(有效成分为NaClO),并研究其相关性质.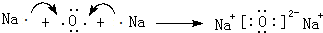 .
.