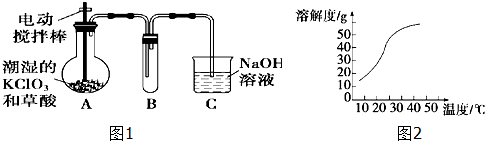
题目内容
10. 某兴趣小组的同学用如图装置制取漂白液(有效成分为NaClO),并研究其相关性质.
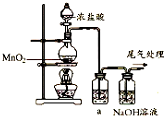
某兴趣小组的同学用如图装置制取漂白液(有效成分为NaClO),并研究其相关性质.(1)组装好仪器后,添加试剂前必须完成的实验操作是检查装置的气密性,实验时烧瓶中反应的化学方程式是MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)试剂a是饱和食盐水,让气体通过试剂a的目的是除去氯气中的氯化氢气体杂质.
(3)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低,为提高NaClO的浓度,他们查阅资料获悉:在溶液中发生反应:
①Cl2(g)+2NaOH(aq)═NaCl(aq)+NaClO(aq)+H2O(l)△H1=-101.1kJ/mol
②3NaClO(aq)═2NaCl(aq)+NaClO3(aq)??△H2=-112.2kJ/mol
反应①的反应速率很快,反应②的反应速度随温度的降低而减慢,请根据上述信息,对该装置提出改进建议:将盛NaOH溶液的洗气瓶浸在冰水中.
(4)该小组同学欲测定所得漂白液中NaClO的含量,原理及操作如下:
测定原理:次氯酸钠在酸性溶液中与KI反应生成I2,再以Na2S2O3标准溶液滴定I2即可.相关反应为:2CH3COOH+2KI+NaClO=I2+NaCl+2CH3COOK;I2+2Na2S2O3=2Nal+Na2S4O6.
该小组同学量取V1mL漂白液置于锥形瓶中,加入足量用醋酸酸化的KI溶液,充分反应后,用cmol/L的Na2S2O3标准溶液来滴定生成的I2,消耗的Na2S2O3标准溶液V2mL.请按要求回答:
①量取V1mL,漂白液所用的仪器是移液管;
②滴定操作中,可选用淀粉溶液作为表示剂来判断反应的终点,反应终点的现象为滴入最后一滴Na2S2O3溶液,蓝色消失,并且半分钟不褪去;
③该漂白液中NaClO的浓度为$\frac{37.25c{V}_{2}}{{V}_{1}}$g/L(用代数式表示).
分析 (1)实验装置在发生反应之前,首先要检查装置的气密性;烧瓶中的反应是浓盐酸和二氧化锰价额反应生成氯气、氯化锰和水;
(2)实验室制取的氯气中含氯化氢,应该用饱和食盐水来除杂;
(3)反应(a)的反应速率很快,反应(b)在室温下较慢,反应是放热反应,所以可以降低温度促进反应a进行;
(4)①次氯酸钠具有氧化性,溶液还具有碱性,据此确定量取液体所用的仪器;
②根据实验原理,硫代硫酸钠滴定碘单质,碘单质遇到淀粉显示蓝色,可以选择淀粉作指示剂;
③根据相关反应:2CH3COOH+2KI+NaClO=I2+NaCl+2CH3COOK;I2+2Na2S2O3=2Nal+Na2S4O6,得到NaClO~2Na2S2O3,根据标准液的量进行相应计算即可.
解答 解:(1)实验装置在发生反应之前,首先要检查装置的气密性;烧瓶中的反应是浓盐酸和二氧化锰价额反应生成氯气、氯化锰和水,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
故答案为:检查装置的气密性;MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)实验室制取的氯气中含氯化氢,应该用饱和食盐水来除去氯气中的氯化氢气体,故答案为:饱和食盐水;除去氯气中的氯化氢气体杂质;
(3)反应(a)的反应速率很快,反应(b)在室温下较慢,反应是放热反应,所以可以降低温度促进反应a进行,将盛NaOH溶液的洗气瓶浸在冰水中;
故答案为:将盛NaOH溶液的洗气瓶浸在冰水中;
(4)①次氯酸钠具有氧化性,溶液还具有碱性,量取液体所用的仪器:移液管,故答案为:移液管;
②根据实验原理,硫代硫酸钠滴定碘单质,碘单质遇到淀粉显示蓝色,可以选择淀粉作指示剂,滴定终点现象是:滴入最后一滴Na2S2O3溶液,蓝色消失,并且半分钟不褪去;
故答案为:淀粉溶液;滴入最后一滴Na2S2O3溶液,蓝色消失,并且半分钟不褪去;
③根据相关反应:2CH3COOH+2KI+NaClO=I2+NaCl+2CH3COOK;I2+2Na2S2O3=2Nal+Na2S4O6,得到NaClO~2Na2S2O3,
设NaClO的浓度是x,NaClO~2Na2S2O3
1 2
V1•x cV2
得到:x=$\frac{c{V}_{2}}{2{V}_{1}}$mol/L,漂白液中NaClO的浓度为x=$\frac{c{V}_{2}}{2{V}_{1}}$mol/L×74.5g/mol=$\frac{37.25c{V}_{2}}{{V}_{1}}$g/L,
故答案为:$\frac{37.25c{V}_{2}}{{V}_{1}}$.
点评 本题考查了氯气的实验室制备,氯气的性质验证和实验方案的设计,掌握实验基础和明确物质的性质是解题关键,题目难度中等.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案| A. |  分离碘和酒精 | B. |  除去CL2中HCL | C. |  实验室制氨气 | D. |  排水法收集NO |
| A. | CO2 | B. | Na2O | C. | Na2O2 | D. | FeSO4 |
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠晶体(Na2S2O3•5H2O)的探究.实验制备装置如图所示(省略夹持装置):

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置B的作用之一是观察SO2的生成速率.B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
③结束反应后,取C中溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(4)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3 Na2S, 一定不含有Na2SO4. |
C6H8O6+I2═C6H6O6+2H++2I- 2S2O32-+I2═S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol•L-1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2.上述滴定时,采用淀粉作指示剂,判断滴定终点的现象是滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色.消耗b mol•L-1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是(aV1-$\frac{b{V}_{2}}{2}$)×10-3mol.