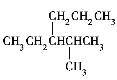题目内容
【题目】我国云南东川铜矿富含辉铜矿(主要成分Cu2S),因含铜成分高而成为重要的炼铜原料。资料表明,当蓝矾溶液渗入地下遇硫铁矿(主要成分:二硫化亚铁FeS2)时,可生成辉铜矿Cu2S,其化学方程式为:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。硫铁矿也是一种重要化工原料,其主要成分可在沸腾炉中鼓入空气高温煅烧生成Fe2O3和一种对环境有污染的有毒气体,回答下列问题:
(1)在化合物FeS2和Cu2S中,硫元素的化合价分别为__、__。
(2)在上述生成辉铜矿的反应中,氧化剂与还原剂的物质的量之比为__。由题中信息可推知Cu2S的溶解情况是:__溶于水(填“不”或“能”,下同),__溶于稀硫酸。
(3)写出硫铁矿的主要成分鼓入空气高温煅烧的化学方程式:__,若反应中有2.2mol电子发生转移时,可生成标准状况下的有毒气体的体积为__L。
【答案】-1 -2 35:3 不 不 4FeS2+11O2![]() 2Fe2O3+8SO2 8.96
2Fe2O3+8SO2 8.96
【解析】
![]() 该反应中铜和7个负一价硫的化合价降低,3个负一价硫的化合价升高。
该反应中铜和7个负一价硫的化合价降低,3个负一价硫的化合价升高。
(1)![]() (二硫化亚铁)中铁为+2价,硫为-1价;
(二硫化亚铁)中铁为+2价,硫为-1价;![]() (硫化亚铜)中铜为+1价,硫为-2价,
(硫化亚铜)中铜为+1价,硫为-2价,
故答案为:-1;-2;
(2)![]() 该反应中铜和7个负一价硫的化合价降低,即14个硫酸铜和3.5个
该反应中铜和7个负一价硫的化合价降低,即14个硫酸铜和3.5个![]() 做氧化剂,3个负一价硫的化合价升高,即1.5个
做氧化剂,3个负一价硫的化合价升高,即1.5个![]() 做还原剂,故氧化剂与还原剂的物质的量之比为35:3;根据反应
做还原剂,故氧化剂与还原剂的物质的量之比为35:3;根据反应![]() 及题目信息,可知
及题目信息,可知![]() 不溶于水,也不溶于稀硫酸,
不溶于水,也不溶于稀硫酸,
故答案为:35:3;不;不;
(3)根据题目信息‘硫铁矿可在沸腾炉中鼓入空气高温煅烧生成![]() 和一种对环境有污染的有毒气体’,可推知
和一种对环境有污染的有毒气体’,可推知![]() 和氧气反应生成
和氧气反应生成![]() 和二氧化硫,方程式为:
和二氧化硫,方程式为: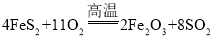 ,该反应转移电子数为44,即转移44个电子生成8个二氧化硫,故当转移2.2mol电子时,生成0.4mol二氧化硫,标况下体积为:8.96L,
,该反应转移电子数为44,即转移44个电子生成8个二氧化硫,故当转移2.2mol电子时,生成0.4mol二氧化硫,标况下体积为:8.96L,
故答案为: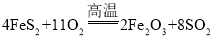 ;8.96。
;8.96。

【题目】1L某混合溶液,可能含有的离子如下表:
可能大量含有的阳离子 | H+、Mg2+、Al3+、NH4+ |
可能大量含有的阴离子 | Cl-、CO32- |
往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。(NH4++OH- =NH3·H2O)

(1)该溶液中一定不含有的离子是___。
(2)V1、V2、V3、V4之间的关系___。
(3)V3V4段离子方程式为___。
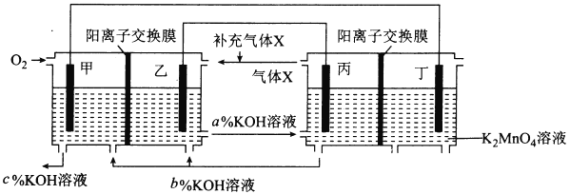
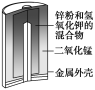
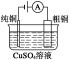
【题目】有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag