��Ŀ����
����Ŀ��ʵ������Ҫ480mL1 mol��L��1 NaOH��Һ��������Һ��������ش��������⣺
��1��ʵ���г���������ƽ(����)��ҩ�ס���Ͳ���ձ������������Ҫ������������____��
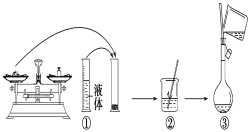
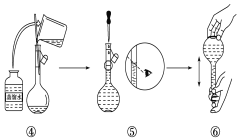
��2����ͼ��ijͬѧ��ʵ�������Ƹ�NaOH��Һ�Ĺ���ʾ��ͼ�������д������____���������ţ���
��3����ȡNaOH����ʱ���������������Ϊ____����д��ĸ����
A. 19.2g B. 20g C. 19.2g ~20g D. ����20g
��4������Һ�����ƹ����У������»���ʵ�鲽�裬����ֻ�����һ�εIJ���������ǣ���д�����������ţ�___ ��
�ٳ��� ���ܽ� ��ת�� ��ϴ�� �ݶ��� ��ҡ��
��5�����в����ᵼ��������Һ�����ʵ���Ũ��ƫ�ߵ���____��
A������NaOH��Һʱ��NaOH�����к���Na2O����
B��������ˮ�ܽ�NaOH���������ת������ƿ�ж���
C�����ݺ���Һ����ڿ��ߣ����ý�ͷ�ιܽ������ˮ����
D������ʱ���ӿ̶���
E����������ƽ���� NaOH ����ʱ����������
F������ǰ����ƿ��������ˮ��
��6����ijͬѧ���ܶ�Ϊ1.2g/cm3����������Ϊ36.5%��Ũ��������100mL3mol/L��ϡ���ᣬ��Ҫ����Ͳ��ȡŨ��������Ϊ____mL��
���𰸡���ͷ�ιܡ�500mL����ƿ �٢ۢ� D �ڢ� ABE 25.0
��������
��1�����������м��㡢�������ܽ⡢��Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ����������ƽ��������ҩ��ȡ��ҩƷ�����ձ����ܽ⣬���ò��������裬�����ܽ⣬��ȴ��ת�Ƶ�500mL����ƿ�У����ò�����������ϴ���ձ���������2��3�Σ�����ϴ��Һ��������ƿ�У���ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�����ݵߵ�ҡ�ȣ���������������������ƽ���ձ�����������500mL����ƿ����ͷ�ιܡ������ṩ��������֪������������500ml����ƿ����ͷ�ιܣ��ʴ�Ϊ����ͷ�ιܡ�500mL����ƿ��
��2������ͲΪ��ȡ���������������ܽ����ʣ��ʢٴ���
���ò�����������ٹ�����ܽ⣬�ʢ���ȷ��
�۲�������������ʱ���������¶�Ӧ��������ƿ�̶����·����ʢ۴���
�ܼ�ˮ���̶��ߵ��·���������ȷ���ʢ���ȷ��
�ݶ���ʱ���۾�Ӧƽ�ӿ̶��ߣ��ʢݴ���
�Ӹ�ҡ�ȣ�ʹ��Һ��Ͼ��ȣ�������ȷ���ʢ���ȷ��
�ʴ�Ϊ���٢ۢݣ�
��3��������480mL������ƿ����ѡ��500mL������ƿ�����Ƴ�500mL��1.0mol/L����Һ��500mL 1.0mol/L������������Һ�к������ʵ�����Ϊ��m��1.0mol/L��0.5L��40g/mol��20g����Ҫ�������������Ƶ�����Ϊ20.0g���������������ƹ���ʱ��Ҫ�ŵ�С�ձ����������ѡ�õ��������������20.0g���ʴ�Ϊ��D��
��4���ٳ���ʱ�ȳƿ��ձ��������ٳ��ձ���ҩƷ���������ʢٴ���
�ڹ������ձ����ܽ⣬��ȴ��ת�Ƶ�500mL����ƿ�У�ֻ��1�Σ��ʢ���ȷ��
��ת��ʱ���˽���Һת�Ƶ�����ƿ�л�Ҫ��ϴ��Һת�Ƶ�����ƿ�У��ʢ۴���
��ϴ��ʱҪϴ���ձ���������2��3�Σ��ʢܴ���
�ݶ���ʱ������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�ʹ��Һ�İ�Һ�����͵��������ƽ��ֻ��1�Σ��ʢ���ȷ��
��ҡ��Ҫ����Һ��ҡ��һ�Σ��ڶ��ݺ���ҡ��һ�Σ��ʢ���
��ѡ���ڢݣ�
��5��A.NaOH�����к���Na2O���ʣ�Na2O����ˮ����ˮ��Ӧ����NaOH������NaOH��������������Һ��Ũ��ƫ�ߣ���A��ȷ��
B.��ˮ�ܽ�NaOH���������ת������ƿ�ж��ݣ��ȵ���Һ���ƫ����ȴ�������С�������Ƶ���Һ���ƫС�����Ƶ���ҺŨ��ƫ�ߣ���B��ȷ��
C.���ݺ���Һ����ڿ��ߣ����ý�ͷ�ιܽ������ˮ�������ᵼ���������ʵ������٣������Ƶ���ҺŨ��ƫ�ͣ���C����
D.����ʱ���ӿ̶���ʹ��Һ���ƫ�������Ƶ���ҺŨ��ƫ�ͣ���D����
E.��������ƽ����NaOH����ʱ���������⣬����NaOH��������������Һ��Ũ��ƫ�ߣ���E��ȷ��
F.����ǰ����ƿ��������ˮ�β�Ӱ���������ʵ�������Һ��������Բ�Ӱ��������Һ��Ũ�ȣ���F����
�ʴ�Ϊ��ABE��
��6���ܶ�Ϊ1.2g/cm3����������Ϊ36.5%��Ũ�������ʵ���Ũ��c=![]() =
=![]() =12mol/L������100mL3mol/L��ϡ���ᣬ���ù�ʽc1V1=c2V2���������ݵ�Ũ��������Ϊ25.0mL���ʴ�Ϊ��25.0��
=12mol/L������100mL3mol/L��ϡ���ᣬ���ù�ʽc1V1=c2V2���������ݵ�Ũ��������Ϊ25.0mL���ʴ�Ϊ��25.0��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����������ʵ��������������õ��Ľ�����ȷ���ǣ� ��
ѡ�� | ʵ����������� | ʵ����� |
A | SO2����ͨ����з�̪��NaOH��Һ�У���Һ��ɫ��ȥ | SO2����Ư���� |
B | ������NO2���ܱղ������������ˮ�У��������ɫ���� | 2NO2(g) |
C | ��ϡ�����ữ��H2O2��Һ����Fe(NO3)2��Һ�У���Һ���ɫ | �����ԣ�H2O2��Fe3+ |
D | ��2֧��ʢ��2mL��ͬŨ��Na3[Ag(S2O3)2]��Һ���Թ��У��ֱ����2����ͬŨ�ȵ�KCl��KI��Һ��ǰ���������������л�ɫ���� | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D
����Ŀ��2016��ȹ��ҿ�ѧ�����������ҹ�ŵ����������������ϣ��������ڿ�ű�������ط�����о���
���������ϣ��������۵�156~157�棬�����ڱ�ͪ���ȷº����ѣ���ˮ�������ܡ�
I.ʵ������������ȡ�����صĹ����������£�

��1���ڲ���IǰҪ��������з��飬��Ŀ����________________
��2������II��������_____________��
��3������III���е����ؽᾧ�����������Ϊ_____ ��_____��______�����ˡ�ϴ�ӡ�����
II����֪��������һ�����ĺ���������Ϊȷ�����Ļ�ѧʽ������������ʵ�飺

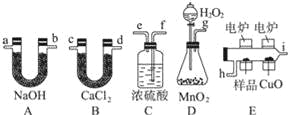
ʵ�鲽�裺������װ�ã����װ�õ������ԡ��ڳ���E��F��������ҩƷ����������ȡ14.10g�����ط���Ӳ���Թ�C�У���ȼC��D���ƾ��Ƽ��ȣ����ȼ�բ�ʵ���������ȴ�����£�������Ӧ��E��F��������ҩƷ��������
��4��װ��E��FӦ�ֱ�װ���ҩƷΪ_______________��___________________��
��5��ʵ���ã�
װ�� | ʵ��ǰ | ʵ��� |
E | 24.00g | 33.90g |
F | 100.00g | 133.00g |
ͨ��������������ص���Է�������Ϊ282������������ݣ��ó������صķ���ʽΪ______��
��6����ʹ����������������ϴ�ʵ������ĸĽ�������________________________��