题目内容
11.高炉炼铁过程中发生的主要反应为:①Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H
已知1000℃时该反应的平衡常数K=64,该温度下降2mol CO,3mol CO2和一定量的Fe2O3,Fe加入10L恒容密闭容器中,10min后反应达到平衡状态.
(1)已知:②4Fe(s)+3O2(g)?2Fe2O3(s)△H=-1647kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282.8kJ•mol-1
则反应①的△H=-24.9kJ•mol-1.
(2)写出反应①的平衡常数表达式:K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$.升高温度,平衡常数减小(填“增大”,“减小”或“不变”)
(3)起始时反应①正向进行(选填“正向进行”或“逆向进行”).欲使气体反应物的转化率达到最大,Fe2O3(填“Fe2O3”或“Fe”)的物质的量不能小于$\frac{1}{3}$.从反应开始至平衡,CO2的平均反应速率为0.01mol/(L•min).
分析 (1)反应①是反应③×3-②×$\frac{1}{2}$得到的,可以根据盖斯定律计算反应的焓变;
(2)平衡常数等于产物平衡浓度系数次方之积和反应物平衡浓度系数次方之积的比值,反应平衡常数和温度有关,对放热反应,升高温度,K降低,对吸热反应,升高温度,K升高;
(3)根据Qc和K的大小确定反应的方向,根据平衡移动的影响因素以及化学反应速率v=$\frac{△c}{△t}$来计算即可.
解答 解:(1)已知:②4Fe(s)+3O2(g)?2Fe2O3(s)△H=-1647kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282.8kJ•mol-1
反应①是③×3-②×$\frac{1}{2}$得到的,所以①得焓变=(-282.8kJ•mol-1)×3-(-1647kJ•mol-1)×$\frac{1}{2}$=-24.9kJ/mol,故答案为:-24.9;
(2)平衡常数等于产物平衡浓度系数次方之积和反应物平衡浓度系数次方之积的比值,反应①的平衡常数表达式:K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,反应平衡常数和温度有关,该反应是放热反应,升高温度,K降低,故答案为:$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$;减小;
(3)根据Qc=$\frac{0.{3}^{3}}{0.{2}^{3}}$=3.375<K,所以化学反应正向进行,达到化学平衡时,设CO的变化浓度是y,氧化铁的初始物质的量是x,
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
初始浓度:0.2 0.3
变化浓度:y y
平衡浓度:0.2-y 0.3+y
$\frac{(0.3+y)^{3}}{(0.2-y)^{3}}$=64,解得y=0.1mol/L,要使得气体反应物的转化率达到最大,则x>0.1mol/L×10L×$\frac{1}{3}$,即其物质的量则要大于$\frac{1}{3}$mol;
从反应开始至平衡,CO2的平均反应速率v=$\frac{△c}{△t}$=$\frac{0.1mol/L}{10min}$=0.01mol/(L•min),
故答案为:正向进行;Fe2O3;$\frac{1}{3}$;0.01mol/(L•min).
点评 本题综合考查盖斯定律的应用、化学反应速率和平衡的计算等知识,属于综合知识的考查,难度不大.

 阅读快车系列答案
阅读快车系列答案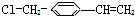 推测它不可能具有下列哪种性质( )
推测它不可能具有下列哪种性质( )| A. | 能被酸性高锰酸钾溶液氧化 | B. | 能使溴水发生加成反应而褪色 | ||
| C. | 能发生水解反应 | D. | 易溶于水,也易溶于有机溶剂 |
| A. | 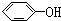 与 与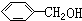 | B. | CH4与C3H8 | ||
| C. | 乙二醇和丙三醇 | D. | CH3CH=CHCH3 和CH2=C(CH3)2 |
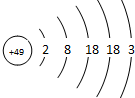 张青莲是我国著名的化学家.1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中的首次采用我国测定的原子量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中的首次采用我国测定的原子量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )| A. | In在反应中容易失电子 | |
| B. | In为长周期元素 | |
| C. | In的最高价氧化物对应的水化物为强碱 | |
| D. | In为过渡元素 |
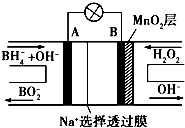 新型NaBH4-H2O2燃料电池(DBFC)的结构如图所示(已知NaBH4中氢为-1价),有关该电池的说法不正确的是( )
新型NaBH4-H2O2燃料电池(DBFC)的结构如图所示(已知NaBH4中氢为-1价),有关该电池的说法不正确的是( )| A. | 放电过程中Na+从A极区向B极区迁移 | |
| B. | 电极B材料中含MnO2层,MnO2起导电作用 | |
| C. | 在电池反应中,每消耗1 L 6 mol•L-1H2O2溶液,理论上流过电路中的电子为12 个NA | |
| D. | 电池负极区的电极反应为BH4-+8OH--8e-=BO2+6H2O |
| A. | 卤素单质Cl2、Br2、I2的氧化性 | |
| B. | 气态氢化物NH3、H2O、HF的稳定性 | |
| C. | 碱金属单质Li、Na、K与水反应的剧烈程度 | |
| D. | 1mol Na、Mg、Al分别与足量盐酸反应时失电子数的多少 |
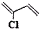 )是制备氯丁橡胶的原料,它只比1,3-丁二烯(
)是制备氯丁橡胶的原料,它只比1,3-丁二烯( )多了一个氯原子,但由于双键上的氢原子很难发生取代反应,不能通过1,3-丁二烯直接与氯气反应制得,2-氯-1,3-丁二烯的逆合成分析为:
)多了一个氯原子,但由于双键上的氢原子很难发生取代反应,不能通过1,3-丁二烯直接与氯气反应制得,2-氯-1,3-丁二烯的逆合成分析为: