题目内容
15.已知合成氨的反应为:N2+3H2═2NH3 △H=-92.4KJ/mol在一定条件下达到化学平衡,现升高温度使平衡发生移动,下列图象中能正确描述正、逆反应速率(v)变化的是( )| A. | 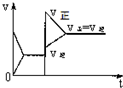 | B. | 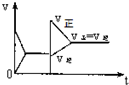 | C. | 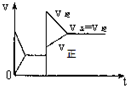 | D. | 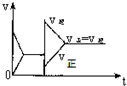 |
分析 该反应的一个反应前后气体体积减小的放热反应,升高温度,正逆反应速率都增大,但平衡逆向移动,达到新的平衡状态时反应速率大于原来平衡时反应速率,据此分析解答.
解答 解:该反应的一个反应前后气体体积减小的放热反应,升高温度,增大活化分子百分数,所以正逆反应速率都增大,改变条件时逆反应速率大于正反应速率,导致平衡逆向移动;因为温度越高反应速率越大,所以达到新的平衡状态时反应速率大于原来平衡时反应速率,故选C.
点评 本题图象分析为载体考查化学反应速率影响因素及平衡移动影响因素,明确化学反应速率影响原理是解本题关键,无论是吸热反应还是放热反应,只要升高温度所有的化学反应速率都增大,题目难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
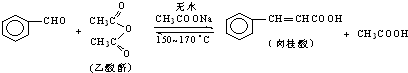
5. 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
药品物理常数
填空:
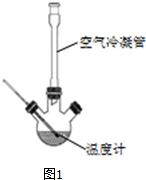
Ⅰ、合成:反应装置如图1所示.向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀.在150~170℃加热1小时,保持微沸状态.
(1)空气冷凝管的作用是使反应物冷凝回流.
(2)该装置的加热方法是空气浴(或油浴).加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是乙酸酐蒸出,反应物减少,平衡左移.
(3)不能用醋酸钠晶体(CH3COONa•3H2O)的原因是乙酸酐遇热水水解.
Ⅱ、粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:

(4)加饱和Na2CO3溶液除了转化醋酸,主要目的是将肉桂酸转化为肉桂酸钠,溶解于水.
(5)操作I是冷却结晶;若所得肉桂酸晶体中仍然有杂质,欲提高纯度可以进行的操作是重结晶(均填操作名称).
(6)设计实验方案检验产品中是否含有苯甲醛取样,加入银氨溶液共热,若有银镜出现,说明含有苯甲醛,或加入用新制氢氧化铜悬浊液,若出现砖红色沉淀,说明含有苯甲醛.
(7)若最后得到纯净的肉桂酸5.0g,则该反应中的产率是75%(保留两位有效数字)
 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
药品物理常数
| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |
| 相对分子质量 | 106 | 102 | 148 | 60 |
Ⅰ、合成:反应装置如图1所示.向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀.在150~170℃加热1小时,保持微沸状态.
(1)空气冷凝管的作用是使反应物冷凝回流.
(2)该装置的加热方法是空气浴(或油浴).加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是乙酸酐蒸出,反应物减少,平衡左移.
(3)不能用醋酸钠晶体(CH3COONa•3H2O)的原因是乙酸酐遇热水水解.
Ⅱ、粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:

(4)加饱和Na2CO3溶液除了转化醋酸,主要目的是将肉桂酸转化为肉桂酸钠,溶解于水.
(5)操作I是冷却结晶;若所得肉桂酸晶体中仍然有杂质,欲提高纯度可以进行的操作是重结晶(均填操作名称).
(6)设计实验方案检验产品中是否含有苯甲醛取样,加入银氨溶液共热,若有银镜出现,说明含有苯甲醛,或加入用新制氢氧化铜悬浊液,若出现砖红色沉淀,说明含有苯甲醛.
(7)若最后得到纯净的肉桂酸5.0g,则该反应中的产率是75%(保留两位有效数字)
6.下列有关氮元素及其化合物的表示正确的是( )
| A. | 质子数为7、中子数为7的氮原子:${\;}_{7}^{7}$N | |
| B. | 氮离子(N3-)的结构示意图: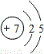 | |
| C. | 氨气分子的电子式: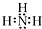 | |
| D. | 甘氨酸分子的结构简式:C2H5O2N |
3.下列有关实验的操作正确的是( )
| A. | 容量瓶可以用来溶解或稀释溶液 | |
| B. | 与硫酸铜溶液反应时可以取用大块的钠 | |
| C. | 可以用排饱和食盐水的方法收集氯气 | |
| D. | 制备氢氧化铁胶体时,需要不断加热和搅拌 |
10.下列指定反应的离子方程式正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | FeSO4溶液与氨水反应的离子方程式:Fe2++2NH3•H2O═Fe(OH)2↓+2NH4+ | |
| C. | 酸性溶液中KIO3与KI反应生成I2:I+I-+6H+═I2+3H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO2↑ |
20.下列叙述错误的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色而甲烷不能 | |
| B. | 1.6g甲烷完全燃烧生成二氧化碳和水,转移的电子数为0.8NA(NA为阿伏加德罗常数) | |
| C. | 1mol苯恰好与3mol H2完全加成,说明一个苯分子中有三个碳碳双键 | |
| D. | 烷烃的通式为CnH2n+2,则n=7,主链上有5个碳原子的烷烃共有五种 |
7.0.2mol Na${\;}_{2}^{18}$O2与足量CO2完全反应后,下表对生成物Na2CO3 和O2的描述中正确的是( )
| Na2CO3的质量 | 关于O2的描述 | |
| A | 21.2g | O2的摩尔质量是36g•mol-1 |
| B | 21.6g | 生成标准状况下O2的体积为2.24L |
| C | 21.6g | O2的摩尔质量是34g•mol-1 |
| D | 22.4g | 生成标准状况下O2的体积为2.24L |
| A. | A | B. | B | C. | C | D. | D |
4.下列有关说法错误的是( )
| A. | H2O2、Na2O2都属于过氧化物、都存在非极性共价键 | |
| B. | H2O2做漂白剂是利用其强氧化性,漂白原理与HClO类似但与SO2不同 | |
| C. | 双氧水是绿色氧化剂,可作医疗消毒剂 | |
| D. | H2O2既有氧化性又有还原性,1molH2O2在参加反应时一定转移2mol电子 |