题目内容
【题目】我们要持之以恒,建设天蓝、地绿、水清的中国.水处理技术在生活、生产中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
(1)①生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行a.杀毒灭菌,b.混凝沉淀,c.过滤等工艺处理,这三项处理的正确顺序是 ______ (填字母)
②工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH值调到9左右,再加入绿矾,请解释这一做法的原因: ______ (用必要的离子方程式和文字描述);
③下列试剂能够用来对自来水进行杀菌消毒,且不会造成二次污染的是 ______ (填字母)
a.福尔马林b.漂白粉c.氯气d.臭氧
④石灰纯碱法是常用的硬水软化方法.已知25℃时Ksp=2.8×10-9,现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为5.6×10-5molL-1,则生成沉淀所需Ca(OH)2溶液的最小浓度为 ______ 。
(2)金属铬污染环境,其主要来源于冶金、水泥等工业产生的废水.某兴趣小组拟定以下流程,对Cr3+、Fe2+等离子的废水进行无公害处理
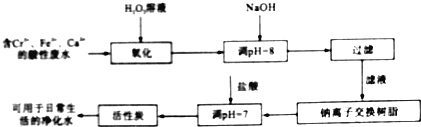
请回答下列问题
①写出加入双氧水后发生反应的离子方程式: ______ ;
②过滤操作需要的玻璃仪器是 ______ ;
③活性炭的作用是 ______ 。
【答案】bca Fe2+在碱性条件下易被氧化成Fe3+,进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH-=4Fe(OH)2(胶体) d 2.0×10-4molL-1 2Fe2++H2O2+2H+=2Fe3++2H2O 烧杯、漏斗、玻璃棒 吸附溶液在水中的杂质,并除去水中的异味
【解析】
(1)①生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行杀菌消毒、混凝沉淀、过滤等工艺处理,这三项处理的正确顺序是混凝沉淀→过滤→杀菌消毒,故答案为:bca;
②工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加绿矾,原因:Fe2+在碱性条件下易被氧化成Fe3+,进而水解生成Fe(OH)3胶体:4Fe2++O2+2H2O+8OH=4Fe(OH)3(胶体),从而起到较好的混凝作用,
故答案为:Fe2+在碱性条件下易被氧化成Fe3+,进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH=4Fe(OH)3(胶体);
③福尔马林有毒,含氯物质可导致二次污染,则能够用来对自来水进行杀菌消毒,且不会造成二次污染的只有臭氧,
故答案为:d;
④Na2CO3溶液的浓度为5.6×105mol/L,等体积混合后溶液中c(CO32)=2.8×105mol/L,根据Ksp=c(CO32)c(Ca2+)=2.8×109可知,c(Ca2+)=![]() mol/L=1×104mol/L,原溶液Ca(OH)2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液Ca(OH)2溶液的最小浓度为2×1×104mol/L=2×104mol/L,
mol/L=1×104mol/L,原溶液Ca(OH)2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液Ca(OH)2溶液的最小浓度为2×1×104mol/L=2×104mol/L,
故答案为:2.0×104molL1;
(2)含Cr3+、Fe2+、Ca2+等离子的废水加入过氧化氢,可氧化Fe2+生成Fe3+,然后加入NaOH溶液调节pH=8可除去Cr3+、Fe3+,过滤后滤液用钠离子交换树脂除去Ca2+,最后用活性炭吸附溶解在水中的杂质,并除去水中的异味,可得用于日常生活的净化水,
①过氧化氢可氧化Fe2+生成Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②过滤常用到的玻璃仪器有烧杯、漏斗、玻璃棒,
故答案为:烧杯、漏斗、玻璃棒;
③活性炭具有吸附作用,可吸附溶解在水中的杂质,并除去水中的异味,
故答案为:吸附溶液在水中的杂质,并除去水中的异味。

 阅读快车系列答案
阅读快车系列答案