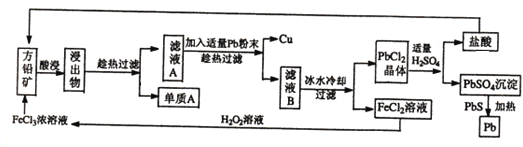
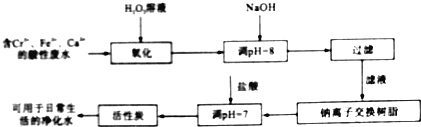
题目内容
【题目】请按要求回答下列问题:
(1)下列物质:①HCl ②NaOH ③Cl2 ④H2O ⑤NH4Cl ⑥MgCl2 ⑦CaF2 ⑧CO2,其中只存在离子键的是:__(用序号回答,下同。);既存在离子键又存在共价键的是:__;试写出⑧的电子式:__;用电子式表示CaF2的形成过程___。
(2)在下列物质中,互为同素异形体的是__;互为同位素的是__。
①液氨和氨气 ②D2和T2 ③![]() K和
K和![]() Ca ④白磷和红磷 ⑤35Cl和37Cl ⑥O2和O3 ⑦12C和14C ⑧S2和S8
Ca ④白磷和红磷 ⑤35Cl和37Cl ⑥O2和O3 ⑦12C和14C ⑧S2和S8
【答案】⑥⑦ ②⑤ ![]()
![]() ④⑥⑧ ⑤⑦
④⑥⑧ ⑤⑦
【解析】
同素异形体为同种元素形成的不同单质,同位素指质子数相同,中子数不同的同一种元素的原子形式。注意一般非金属元素原子之间形成共价键,金属元素和非金属元素或原子团之间形成离子键。据此分析。
(1) ①HCl只有共价键; ②NaOH含有共价键和离子键;③Cl2 只有共价键; ④H2O只有共价键; ⑤NH4Cl 含有共价键和离子键; ⑥MgCl2只有离子键;⑦CaF2 只有离子键; ⑧CO2只有共价键;二氧化碳的电子式为![]() ,
,![]() ;
;
(2) ①液氨和氨气为同一种物质;②D2和T2都为氢气;③![]() K和
K和![]() Ca不是同位素也不是同素异形体;④白磷和红磷是同素异形体; ⑤35Cl和37Cl为同位素; ⑥O2和O3为同素异形体;⑦12C和14C 为同位素;⑧S2和S8为同素异形体。故同素异形体为④⑥⑧,同位素为⑤⑦。
Ca不是同位素也不是同素异形体;④白磷和红磷是同素异形体; ⑤35Cl和37Cl为同位素; ⑥O2和O3为同素异形体;⑦12C和14C 为同位素;⑧S2和S8为同素异形体。故同素异形体为④⑥⑧,同位素为⑤⑦。

【题目】氮氧化物是评价空气质量的控制标准之一,作为空气污染物的氮氧化物(NOx)常指NO和NO2。
(1)下列关于氮氧化物有关叙述不正确的是:_______(填序号)
①对人体及动物有毒害作用;②造成土壤污染;③一氧化氮可结合血红蛋白造成人体缺氧;④是形成酸雨、酸雾的主要原因之一; ⑤增高大气温度;⑥与碳氢化合物形成光化学烟雾;⑦参与臭氧层的破坏;⑧一氧化氮分子作为一种传递神经信息的 信使分子 ,在使血管扩张,免疫,增强记忆力
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO(g) ![]() 2N2(g)+CO2(g)+2H2O(g)的ΔH=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)的ΔH=-1160kJ·mol-1
2NO2(g)+N2(g) ![]() 4NO(g) ΔH=+293 kJ·mol-1
4NO(g) ΔH=+293 kJ·mol-1
则该条件下,CH4催化还原NO2消除污染的热化学方程式为_______________。
(3)T1℃时,在刚性反应器中以投料比为1:3的NO(g)与O2(g)反应,其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。
t/min | 0 | 40 | 80 | 160 | 260 | 700 | ∞ |
p/kPa | 32.8 | 30.7 | 29.9 | 29.4 | 29.2 | 28.8 | 26.9 |
①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=42 min时,测得体系中p(O2)=22.4 kPa,则此时的v=_________kPa·min-1(计算结果保留1位小数)。
②若降低反应温度至T2℃,则NO(g)与O2(g)完全反应后体系压强p∞(T2℃)_________(填“大于”“等于”或“小于”)26.9kPa,原因是___________________________________。
③T1℃时,反应N2O4(g) ![]() 2NO2(g)的平衡常数Kp=___kPa(Kp为以分压表示的平衡常数,是指平衡时体系中生成气体压强幂之积与反应物气体压强幂之积的比值。计算结果保留3位小数)。
2NO2(g)的平衡常数Kp=___kPa(Kp为以分压表示的平衡常数,是指平衡时体系中生成气体压强幂之积与反应物气体压强幂之积的比值。计算结果保留3位小数)。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(两者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。