题目内容
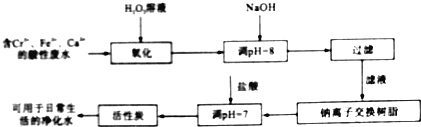
【题目】以海绵铜(CuO、Cu)为原料制备氯化亚铜(CuCl)的一种工艺流程如下。

(1)“溶解”过程:生成CuSO4的反应方程式:CuO + H2SO4 === CuSO4 + H2O、________。
(2)“吸收”过程:
① 2NO(g) + O2(g) ![]() 2NO2(g) H = -112.6 kJ·mol-1
2NO2(g) H = -112.6 kJ·mol-1
提高NO平衡转化率的方法是________(写出两种)。
② 吸收NO2的有关反应如下:
反应Ⅰ:2NO2(g) + H2O(l) === HNO3(aq) + HNO2(aq) H = -116.1 kJ·mol-1
反应Ⅱ:3HNO2(aq) === HNO3(aq) + 2NO(g) + H2O(l) H = -75.9 kJ·mol-1
用水吸收NO2生成HNO3和NO的热化学方程式是________。
(3)“电解”过程:
HNO2为弱酸。通过电解使HNO3得以再生,阳极的电极反应式是________。
(4)“沉淀”过程:
① 产生CuCl的离子方程式是_________。
② 加入适量Na2CO3,能使沉淀反应更完全,原因是_________。
(5)测定CuCl含量:
称取氯化亚铜样品m g,用过量的FeCl3溶液溶解,充分反应后加入适量稀硫酸,用x mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液y mL。滴定时发生的离子反应:Cr2O72- + 6Fe2+ + 14H+ === 2Cr3+ + 6Fe3+ + 7H2O样品中CuCl(M=99.5 g·mol-1)的质量分数为________。
【答案】![]() 降低温度、增大压强、提高
降低温度、增大压强、提高![]() 等 3NO2(g)+H2O(g)=2HNO3(aq)+NO(g)△H=-212.1kJ·mol-1
等 3NO2(g)+H2O(g)=2HNO3(aq)+NO(g)△H=-212.1kJ·mol-1 ![]()
![]()
![]() 消耗
消耗![]() ,使
,使![]() 减小,有利于生成CuCl的反应正向进行
减小,有利于生成CuCl的反应正向进行 ![]()
【解析】
海绵铜(CuO、Cu)中CuO与稀硫酸反应转化为硫酸铜,因硝酸在酸性条件下具有氧化性,会将Cu氧化为铜离子,最终生成硫酸铜,二氧化硫具有还原性,再讲铜离子还原为氯化亚铜;NO合理利用经过氧化与电解过程得到硝酸,据此分析作答。
(1)“溶解”过程除了氧化铜溶于稀硫酸过程,Cu在酸性条件下与硝酸会发生氧化还原反应,其化学方程式为:![]() ,故答案为:
,故答案为: ![]() ;
;
(2)① 2NO(g) + O2(g) ![]() 2NO2(g) H = -112.6 kJ·mol-1,该反应正向是气体体积分数减小的放热反应,则提高NO平衡转化率的方法可以为:降低温度、增大压强、提高
2NO2(g) H = -112.6 kJ·mol-1,该反应正向是气体体积分数减小的放热反应,则提高NO平衡转化率的方法可以为:降低温度、增大压强、提高![]() 等(任写两种即可);
等(任写两种即可);
②根据盖斯定律可知,![]() (反应Ⅰ×3+反应Ⅱ)得到用水吸收NO2生成HNO3和NO的热化学方程式为:3NO2(g)+H2O(g)=2HNO3(aq)+NO(g) △H=-
(反应Ⅰ×3+反应Ⅱ)得到用水吸收NO2生成HNO3和NO的热化学方程式为:3NO2(g)+H2O(g)=2HNO3(aq)+NO(g) △H=-![]() [-116.1 kJ·mol-1×3+(-75.9 kJ·mol-1)]=-212.1kJ·mol-1,故答案为:3NO2(g)+H2O(g)=2HNO3(aq)+NO(g)△H=-212.1kJ·mol-1;
[-116.1 kJ·mol-1×3+(-75.9 kJ·mol-1)]=-212.1kJ·mol-1,故答案为:3NO2(g)+H2O(g)=2HNO3(aq)+NO(g)△H=-212.1kJ·mol-1;
(3)电解过程中,阳极HNO2发生失电子的氧化反应生成硝酸,其电极反应式为![]() ;
;
(4)①铜离子与二氧化硫发生氧化还原反应生成氯化亚铜,其离子方程式为:![]() ;
;
②生成氯化亚铜沉淀的方程式为:![]() ,反应中有硫酸生成,加入适量Na2CO3,其中
,反应中有硫酸生成,加入适量Na2CO3,其中![]() 消耗
消耗![]() ,使
,使![]() 减小,有利于生成CuCl的反应正向进行;
减小,有利于生成CuCl的反应正向进行;
(5)氯化亚铜与氯化铁发生反应:Fe3++CuCl=Fe2++Cu2++Cl-,加入K2Cr2O7溶液,发生反应:6Fe2+Cr2O72-+14H+=6Fe3++2Cr3++7H2O,反应的关系式为
6CuCl~6Fe2+~Cr2O72-
6 1
n xy×10-3mol
n=6xy×10-3mol
m(CuCl)=99.5g/mol×6xy×10-3mol=0.597xy g
则样品中CuCl的质量分数为![]() 。
。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案