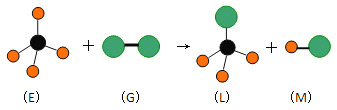
题目内容
【题目】已知肼(N2H4)和强氧化剂过氧化氢常用作火箭燃料,火箭部分构件采用钛合金材料。请回答下列问题:
(1)N2H4、H2O2的组成元素中第一电离能最大的是______。
(2)钛元素基态原子的核外电子排布式为_____________________。
(3)1 mol N2H4分子中所含极性键的数目为___________。
(4)H2O2受热易分解为H2O,H2O的空间构型为_______,其中心原子的杂化轨道类型为_________。
(5)H2S和H2O2的主要物理性质如下表所示:
物质 | 熔点/K | 沸点/K | 水中溶解度(标准状况) |
H2S | 187 | 202 | 每升水中溶解2.6 L |
H2O2 | 272 | 423 | 以任意比互溶 |
造成上述熔沸点和溶解度差异的主要原因分别是_______________和________________。
(6)氧化镁和氮化硼均可用作返回舱的热屏蔽材料,晶格能:氧化镁_______(填“大于”或“小于”)氧化钙。
(7)立方氮化硼的晶胞如图所示。处于晶胞顶点的原子的配位数为______。若晶胞边长为a cm,则立方氮化硼的密度是________________g·cm-3。(只要求列出算式,设阿伏加德罗常数的值为NA)
【答案】N 1s22s22p63s23p63d24s2或[Ar]3d24s2 2.41×1024 V形 sp3 H2O2分子之间存在氢键,所以H2O2的熔、沸点高于H2S H2O2与H2O分子之间也可形成氢键,故H2O2在水中的溶解度大于H2S 大于 4 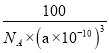
【解析】
(1)N、H、O元素中氮元素2p能级为半满稳定状态,第一电离能最大。
(2)钛元素为第22号元素,根据素基态原子的核外电子排布式为[Ar]3d24s2。
(3)每个N2H4分子中,两个氮原子之间有一个非极性共价键,氮原子和氢原子间有4个极性共价键。
(4)H2O中氧原子形成2个氢氧键,含有2对孤对电子,杂化轨道数目为4。
(5)H2O2分子间形成氢键,所以沸点高于H2S。H2O2和H2O分子之间也形成氢键,增大溶解度。
(6)离子所带电荷数相等,离子半径越小,晶格能越大。
(7)以B原子为中心,距离最近且相等的N原子有4个,N原子距离最近且相等的B原子也有4个,B原子配位数为4,N原子配位数也是4。根据均摊法计算晶胞中氮、硼原子个数,晶胞质量,晶胞体积,再计算立方氮化硼的密度。
(1)N2H4、H2O2的组成元素中,氮元素2p能级为半满稳定状态,第一电离能最大。答案为N。
(2)钛元素为第22号元素,根据素基态原子的核外电子排布式为[Ar]3d24s2。
(3)每个N2H4分子中,氮原子和氢原子间有4个极性共价键,1 mol N2H4分子中所含极性键的数目为4×6.02×1023=2.408×1024≈2.4×1024。
(4)H2O中氧原子形成2个氢氧键,含有2对孤对电子,杂化轨道数目为4,H2O的空间构型为V形,其中心原子的杂化轨道类型为sp3。
(5)造成上述熔沸点和溶解度差异的主要原因分别是:H2O2分子之间存在氢键,所以H2O2的熔、沸点高于H2S;H2O2与H2O分子之间也可形成氢键,故H2O2在水中的溶解度大于H2S。
(6)镁离子半径小于钙离子半径,所带电荷数相等,所以晶格能:氧化镁大于氧化钙。
(7)以B原子为中心,距离最近且相等的N原子有4个,N原子距离最近且相等的B原子也有4个,B原子配位数为4,N原子配位数也是4。根据均摊法计算晶胞中氮、硼原子个数,一个立方氮化硼的晶胞钟含有4个氮原子,4个B原子,晶胞质量![]() g=
g=![]() g,晶胞体积(a×10-10)3cm3,立方氮化硼的密度
g,晶胞体积(a×10-10)3cm3,立方氮化硼的密度![]() g÷(a×10-10)3cm3 =
g÷(a×10-10)3cm3 = 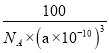 g·cm-3。
g·cm-3。

【题目】下列“实际应用”对应“化学知识原理”说法错误的是( )
选项 | 实际应用 | 化学知识原理 |
A | 泡沫灭火器中装有碳酸氢钠溶液 和硫酸铝溶液 | 碳酸氢钠溶液和硫酸铝溶液水解且相互促进 |
B | 工业上采用高压(20-50MPa)合成NH3 | 应用勒夏特列原理 |
C | 施加石膏降低盐碱地(含Na2CO3)的碱性 | CaCO3溶度积小于CaSO4 |
D | 选用金属锂做电池电极材料 | 锂轻且在空气中稳定 |
A. AB. BC. CD. D
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g) + 3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol):
2NH3(g) △H=-92.4kJ/mol):
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molN2、3molH2 | 2molNH3 | 1molNH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强 | P1 | P2 | P3 |
反应物转化率 | α1 | α2 | α3 |
下列说法不正确的是( )
A.![]() >c3B.a + b=92.4C.P2>2P3D.α1 +α3>1
>c3B.a + b=92.4C.P2>2P3D.α1 +α3>1
【题目】Ⅰ.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1;②CO(g)+2H2(g)
CH3OH(g)+H2O(g) △H1;②CO(g)+2H2(g)![]() CH3OH(g) △H2 ③CO2(g)+H2(g)
CH3OH(g) △H2 ③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3;
CO(g)+H2O(g) △H3;
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | X |
回答下列问题:
(1)已知△H2=-99 kJ·mol-1,则根据上表相关的化学键键能(“C![]() O”表示CO的化学键)计算X=_______ kJ·mol-1。
O”表示CO的化学键)计算X=_______ kJ·mol-1。
(2)反应①、②、③对应的平衡常数K1、K2、K3之间的关系式为___________。
(3)根据化学反应原理,分析增大压强对反应③的影响为_______________。(提示:从对反应速率、平衡状态、转化率角度回答)
Ⅱ.清洁能源具有广阔的开发和应用前景,可减小污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)△H=-99kJmol-1。向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g)△H=-99kJmol-1。向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
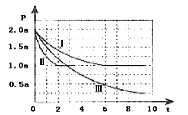
①Ⅱ和Ⅰ相比,改变的反应条件是_________;
②反应Ⅰ在6min时到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=_________;
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=_________;
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1_____T3(填“>”“<”“=”),判断的理由是_________。
【题目】过碳酸钠(2Na2CO33H2O2)俗称固体双氧水。实验室可用碳酸钠和双氧水等为原料来制备,具体流程如下:

已知:①相关反应的方程式如下:2Na2CO3+3H2O2=2Na2CO33H2O2△H<0
②工业上常以产品活性氧的质量分数[ω(活性氧)=![]() ×100%]来衡量产品的优劣,13.00%以上为优等品。
×100%]来衡量产品的优劣,13.00%以上为优等品。
请回答:
表1 反应温度对产品收率及活性氧含量的影响
反应温度/℃ | 产品收率/% | 活性氧质量分数/% |
5 | 65.3 | 12.71 |
10 | 73.2 | 13.24 |
15 | 85.0 | 13.55 |
20 | 83.2 | 13.30 |
25 | 55.1 | 12.78 |
表2加料时间对产品收率及活性氧含量的影响
加料时间/min | 产品收率/% | 活性氧质量分数/% |
5 | 65.7 | 13.30 |
10 | 76.8 | 14.75 |
15 | 81.3 | 14.26 |
20 | 89.0 | 13.82 |
25 | 87.9 | 13.51 |
(1)分析表1,一般选择的反应温度为_____。
(2)分析表2,加料时间对产品收率也有很大影响,时间太短或太长均不利于生产,加料时间太短导致产品收率较低的原因是_____。
(3)结晶过程中加入氯化钠,作用是_____。
(4)下列关于抽滤操作,正确的是_____。
A.准备略大于漏斗内径的滤纸,以盖住布氏漏斗瓷板上的小孔
B.用倾析法先转移溶液,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,加入少量水并开大水龙头,重复操作2~3次
D.用玻璃棒轻轻刮下抽滤得到的固体,晾干后保存在试剂瓶中
(5)使用图2所示装置抽滤,中途需停止抽滤时,最佳操作为_____。
(6)产品出厂前需测定活性氧的质量分数,现将0.1000g某厂的产品(所含杂质均不参与反应)溶于水配成溶液,加入10.00mL1.000molL﹣1的稀硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量_____,用0.1000molL﹣1的Na2S2O3标准溶液滴定,若该产品的活性氧质量分数为13.60%,则达到滴定终点时共消耗标准液的体积为_____mL。[已知:2Na2S2O3+I2=Na2S4O6+2NaI]