题目内容
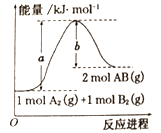
【题目】一定温度下,冰醋酸加水稀释的过程中,溶液导电能力(I)随加水的体积(V)变化如图所示,下列说法正确的是( )
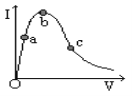
A.“O”点导电能力为0的理由是冰醋酸是固体,内部的离子不能自由移动
B.a、b、c三点中,a点c(H+)最大,因为电解质溶液浓度越大,离子浓度就越大
C.a、b、c三点中,a点水电离的程度最小
D.加大量水稀释,溶液中所有微粒浓度都减小
【答案】C
【解析】
A. 无论冰醋酸是固态或液态,都不导电,因为无水醋酸不电离,而不是因为内部的离子不能自由移动,故A错误;
B. 溶液的导电能力由离子浓度决定,题目图象说明冰醋酸加水稀释过程中,导电能力随水的加入逐渐增大到最大值又逐渐减小,故c(H+)是b点最大,c点最小,故B错误;
C. 溶液越稀,越促进醋酸电离,冰醋酸加水稀释的过程中,c点水电离的程度最大,a点水电离的程度最小,故C正确;
D. 溶液显酸性,向溶液中加水,溶液中主要存在的离子浓度都减小,根据水的离子积常数,氢氧根离子浓度增大,故D错误;

【题目】已知肼(N2H4)和强氧化剂过氧化氢常用作火箭燃料,火箭部分构件采用钛合金材料。请回答下列问题:
(1)N2H4、H2O2的组成元素中第一电离能最大的是______。
(2)钛元素基态原子的核外电子排布式为_____________________。
(3)1 mol N2H4分子中所含极性键的数目为___________。
(4)H2O2受热易分解为H2O,H2O的空间构型为_______,其中心原子的杂化轨道类型为_________。
(5)H2S和H2O2的主要物理性质如下表所示:
物质 | 熔点/K | 沸点/K | 水中溶解度(标准状况) |
H2S | 187 | 202 | 每升水中溶解2.6 L |
H2O2 | 272 | 423 | 以任意比互溶 |
造成上述熔沸点和溶解度差异的主要原因分别是_______________和________________。
(6)氧化镁和氮化硼均可用作返回舱的热屏蔽材料,晶格能:氧化镁_______(填“大于”或“小于”)氧化钙。
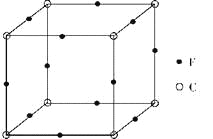
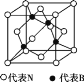
(7)立方氮化硼的晶胞如图所示。处于晶胞顶点的原子的配位数为______。若晶胞边长为a cm,则立方氮化硼的密度是________________g·cm-3。(只要求列出算式,设阿伏加德罗常数的值为NA)
【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
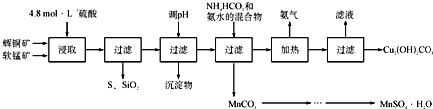
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0molL-1计算):
开始沉淀的pH | 沉淀完全的pH | |
Fe 3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有____________________(任写一点);
(2)调节浸出液pH的范围为____________,其目的是_______________________;
(3)本工艺中可循环使用的物质是____________________(写化学式).
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成_________________的结果;
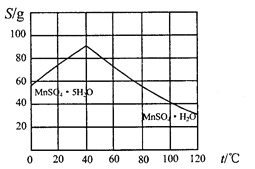
(5)碳酸锰在一定条件下可得硫酸锰溶液,试根据如下曲线图示,现由硫酸锰溶液制备MnSO4·H2O的实验方案为____________________。
(6)用标准BaCl2溶液测定样品中MnSO4H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有_________________(任写一种)。