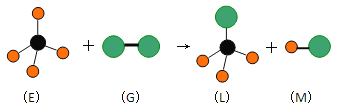
��Ŀ����
����Ŀ����.���úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�������������Ӧ���£���CO2(g)+3H2(g)![]() CH3OH��g��+H2O(g) ��H1����CO(g)+2H2(g)
CH3OH��g��+H2O(g) ��H1����CO(g)+2H2(g)![]() CH3OH(g) ��H2 ��CO2(g)+H2(g)
CH3OH(g) ��H2 ��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H3��
CO(g)+H2O(g) ��H3��
��ѧ�� | H-H | C-O | C | H-O | C-H |
E/��kJ��mol-1�� | 436 | 343 | 1076 | 465 | X |
�ش��������⣺
��1����֪��H2=-99 kJ��mol-1��������ϱ���صĻ�ѧ�����ܣ���C![]() O����ʾCO�Ļ�ѧ��������X=_______ kJ��mol-1��
O����ʾCO�Ļ�ѧ��������X=_______ kJ��mol-1��
��2����Ӧ�١��ڡ��۶�Ӧ��ƽ�ⳣ��K1��K2��K3֮��Ĺ�ϵʽΪ___________��
��3�����ݻ�ѧ��Ӧԭ������������ѹǿ�Է�Ӧ�۵�Ӱ��Ϊ_______________������ʾ���ӶԷ�Ӧ���ʡ�ƽ��״̬��ת���ʽǶȻش�
��.�����Դ���й����Ŀ�����Ӧ��ǰ�����ɼ�С��Ⱦ����������⣬���м״������������ʵ����ȼ�ϣ�������ȼ�ϵ�ء�һ����������CO��H2�ϳ�CH3OH��CO��g��+2H2��g��![]() CH3OH��g����H=-99kJmol-1�������Ϊ2L���ܱ������г���2molCO��4molH2����ò�ͬ�¶��������ڵ�ѹǿ��P��kPa����ʱ�䣨min���ı仯��ϵ��ͼ�Т�������ʾ��
CH3OH��g����H=-99kJmol-1�������Ϊ2L���ܱ������г���2molCO��4molH2����ò�ͬ�¶��������ڵ�ѹǿ��P��kPa����ʱ�䣨min���ı仯��ϵ��ͼ�Т�������ʾ��

�٢�͢���ȣ��ı�ķ�Ӧ������_________��
�ڷ�Ӧ����6minʱ��ƽ�⣬�ڴ������´ӷ�Ӧ��ʼ���ﵽƽ��ʱv��CH3OH��=_________��
�۷�Ӧ����2minʱ�ﵽƽ�⣬ƽ�ⳣ��K����=_________��
�ܱȽϷ�Ӧ����¶ȣ�T1���ͷ�Ӧ����¶ȣ�T3���ĸߵͣ�T1_____T3���������������=�������жϵ�������_________��
���𰸡�413 K1=K2��K3������K3=K1/K2�� ����ѹǿ����Ӧ���ʼӿ죬ƽ�ⲻ�ƶ�����Ӧ���ת���ʲ��� ����ʹ�ô��� 0.125 mol/��L��min�� 12 �� ��ӦΪ���ȷ�Ӧ�������¶ȣ���Ӧ���ʼ�����ƽ��������Ӧ�����ƶ�
��������
��1����Ӧ�ȵ��ڶϼ����յ��������γɻ�ѧ�����ų��������IJ�ֵ������ݱ������ݺͷ�Ӧ�Ļ�ѧ����ʽCO(g)+2H2(g)![]() CH3OH(g)��֪��Ӧ�ȡ�H2=1076 kJ��mol-1+ 2��436kJ��mol-1-3x-343 kJ��mol-1-465 kJ��mol-1=-99 kJ��mol-1�����x=413��
CH3OH(g)��֪��Ӧ�ȡ�H2=1076 kJ��mol-1+ 2��436kJ��mol-1-3x-343 kJ��mol-1-465 kJ��mol-1=-99 kJ��mol-1�����x=413��
��2��K1=![]() ��K2=
��K2= ��K3=
��K3= ��K1=
��K1=![]() =
=
 =K2��K3��
=K2��K3��
��3����CO2(g)+H2(g)![]() CO(g)+H2O(g)����Ӧ����������䣬������ѹǿ����Ӧ���ʼӿ죬ƽ�ⲻ�ƶ�����Ӧ���ת���ʲ��䣻
CO(g)+H2O(g)����Ӧ����������䣬������ѹǿ����Ӧ���ʼӿ죬ƽ�ⲻ�ƶ�����Ӧ���ת���ʲ��䣻
��4���٢�͢���ȷ�Ӧ���ʼӿ죬��Ӱ��ƽ���ƶ�������ӦΪ�������ʵ�����С�ķ�Ӧ��Ӧ��ʹ�ô������ʴ�Ϊ������ʹ�ô�����
�ں��º����£�ѹǿ֮�ȵ����������ʵ���֮�ȣ���ƽ��ʱ������������ʵ���Ϊ(2+4)mol��![]() =3mol����
=3mol����
CO(g)+2H2(g) ![]() CH3OH(g) ���ʵ�����С��n=2
CH3OH(g) ���ʵ�����С��n=2
��ʼ��(mol) 2 4 0
�仯��(mol) 1.5 3 1.5 6��3=3
ƽ����(mol) 0.5 1 1.5
��v(CH3OH)=  =0.125mol/(L.min)��
=0.125mol/(L.min)��
�ۢ��¶���ͬ��ƽ�ⳣ����ͬ��ƽ�ⳣ��K(��)=K=  =
=  =12��
=12��
�ܷ�Ӧ���ƽ��ʱ���õ�ʱ��ȷ�Ӧ���ƽ��ʱ���õ�ʱ�䳤����ѧ��Ӧ���������Ң�ƽ��ʱѹǿ��IС����I���ƽ�������ƶ�������ӦΪ���������С���ȷ�Ӧ��Ӧ�����¶ȣ����¶�T1�¶ȸ��ߡ�

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����֪��(N2H4)��ǿ�������������ⳣ�������ȼ��,������ֹ��������ѺϽ���ϡ���ش���������:
��1��N2H4��H2O2�����Ԫ���е�һ������������______��
��2����Ԫ�ػ�̬ԭ�ӵĺ�������Ų�ʽΪ_____________________��
��3��1 mol N2H4�������������Լ�����ĿΪ___________��
��4��H2O2�����ֽ�ΪH2O,H2O�Ŀռ乹��Ϊ_______,������ԭ�ӵ��ӻ��������Ϊ_________��
��5��H2S��H2O2����Ҫ�����������±���ʾ:
���� | �۵�/K | �е�/K | ˮ���ܽ��(��״��) |
H2S | 187 | 202 | ÿ��ˮ���ܽ�2.6 L |
H2O2 | 272 | 423 | ������Ȼ��� |
��������۷е���ܽ�Ȳ������Ҫԭ��ֱ���_______________��________________��
��6������þ�͵���������������زյ������β���,������:����þ_______(����ڡ���С�ڡ�)�����ơ�
��7������������ľ�����ͼ��ʾ�����ھ��������ԭ�ӵ���λ��Ϊ______���������߳�Ϊa cm,��������������ܶ���________________g��cm-3��(ֻҪ���г���ʽ,�谢���ӵ�������ֵΪNA)

����Ŀ����ͭ����Ҫ�ɷ�ΪCu2S�����̿���Ҫ�ɷ�ΪMnO2�����Ƕ���������SiO2��Fe2O3�����ʡ���ҵ���ۺ����������ֿ����Ʊ������̺ͼ�ʽ̼��ͭ����Ҫ�����������£�

��֪����MnO2�ܽ����������е�������Ϊ������
��[Cu(NH3)4]SO4�����ȶ�������ˮ�л�ֽ�����NH3��
�����ֽ��������������������������pH��Χ���±���ʾ(��ʼ������pH����������Ũ��Ϊ1.0molL-1����)��
��ʼ������pH | ������ȫ��pH | |
Fe 3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
��1�����ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ��____________________(��дһ��)��
��2�����ڽ���ҺpH�ķ�ΧΪ____________����Ŀ����_______________________��
��3���������п�ѭ��ʹ�õ�������____________________(д��ѧʽ)��
��4���ڸù��յ����������������ڣ������ȵ��¶Ƚϵͻ���ߣ��������_________________�Ľ����
��5��̼������һ�������¿ɵ���������Һ���Ը�����������ͼʾ��������������Һ�Ʊ�MnSO4��H2O��ʵ�鷽��Ϊ____________________��

��6���ñ�BaCl2��Һ�ⶨ��Ʒ��MnSO4H2O��������ʱ��������Ʒ���ȴ���100%(�ⶨ�����в��������ɺ���)�������ԭ����_________________(��дһ��)��