题目内容
镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g)=MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g)=Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) = 2Mg(s)+Mg2NiH4(s) △H3
则△H3 = kJ·mol-1。
(2)工业上可用电解熔融的无水氯化镁获得镁。其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4Cl·nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 ;电解熔融氯化镁,阴极的电极反应式为 。
(3)储氢材料Mg(AlH4)2在110-200°C的反应为:Mg(AlH4)2=MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为 。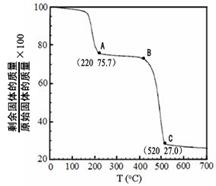
(4)工业上用MgC2O4·2H2O热分解制超细MgO,其热分解曲线如图。
图中隔绝空气条件下B→C发生反应的化学方程式为 。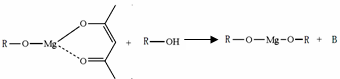
(5)一种有机镁化合物可用于制造光学元件的涂布液,化学式可表示为: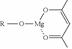 ,它可发生如下反应:
,它可发生如下反应:
ROH与B的核磁共振氢谱如下图: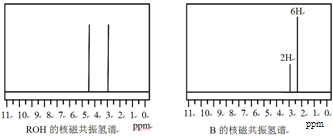
ROH由C、H、O、F四种元素组成的含氟有机物,分子中只有1个氧原子,所有氟原子化学环境相同,相对分子质量为168,则ROH的结构简式为 ; B的结构简式为 。
(1)+84.6(2分)。
(2)MgCl2·NH4Cl·nNH3 MgCl2 +(n+1)NH3↑ + HCl↑ (2分); Mg2++2e-= Mg(2分)。
MgCl2 +(n+1)NH3↑ + HCl↑ (2分); Mg2++2e-= Mg(2分)。
(3)3mol(2分)。(4)MgC2O4 MgO + CO↑+ CO2↑(2分)
MgO + CO↑+ CO2↑(2分)
(5)(CF3)2CHOH (2分); (2分)。
(2分)。
解析试题分析:(1)方程式②-①×2=-64.4-(-74.5)×2=+84.6 kJ·mol-1;(2)化合物分解得到无水氯化镁、氨气、和氯化氢;阴极阳离子放电;(3)该反应中只有铝元素化合价降低,由+3价到0价,生成1mol铝,电子转移3mol;(4)根据图数据计算分析,若总质量为148g,第一次分解产物质量为148×75.7%=112g,第二次分解产物的质量为148×27%=40g,所以A点生成MgC2O4,C点生成MgO;B→C发生反应为MgC2O4 MgO + CO↑+ CO2↑;(5)根据信息含有1个羟基,图谱中显示物质中含有2中化学环境的氢且数目相同,即物质中只含有两个氢原子,其它全被氟取代,根据相对分子质量确定为(CF3)2CHOH。
MgO + CO↑+ CO2↑;(5)根据信息含有1个羟基,图谱中显示物质中含有2中化学环境的氢且数目相同,即物质中只含有两个氢原子,其它全被氟取代,根据相对分子质量确定为(CF3)2CHOH。
考点:考查STS中环境保护有关问题。

钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,该反应的反应物与生成物有CO、Pd、H2O、HCl、PdCl2和一种未知物质X。下列说法错误的是
| A.未知物质X为CO2,属于氧化产物 |
| B.每转移1mol e-时,生成2mol X |
| C.反应中PdCl2作氧化剂,被还原 |
| D.还原性:CO>Pd |
 还原为N2。25℃时,反应进行10 min,溶液的pH由7变为12(常温下)。
还原为N2。25℃时,反应进行10 min,溶液的pH由7变为12(常温下)。
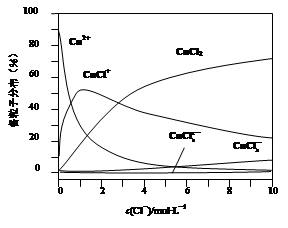
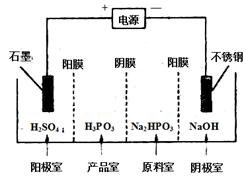
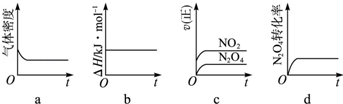
 CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。
CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。

 Ag2O2↓+2KNO3+2K2SO4+2H2O
Ag2O2↓+2KNO3+2K2SO4+2H2O