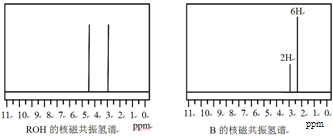
题目内容
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1,①
2Cu2O(s) + Cu2S(s) =" 6Cu(s)" + SO2(g) △H=+116.0kJ·mol-1,②
①热化学方程式:Cu2S(s) + O2(g) =" 2Cu(s)" + SO2(g) △H= kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4 + 3H3PO2 + 6H2O =" 4CuH↓" + 4H2SO4 + 3H3PO4 。
①该反应还原剂是 (写化学式)。
②该反应每转移3 mol电子,生成CuH的物质的量为 。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图。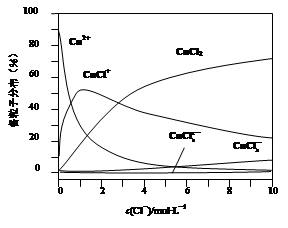
①当c(Cl-)="9" mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)="1" mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
(4) 电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。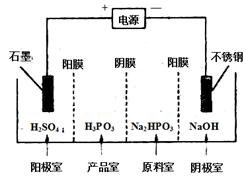
(16分)(1)①Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=-217.4KJ/mol;(2分)
②阳;(2分)
(2)①H3PO2(2分);②1mol(2分);
(3)①c(CuCl2)>c(CuCl+)>c(CuCl3-)(2分);
②Cu2++Cl-═CuCl+(2分).
(4)①4OH--4e-=2H2O+O2↑(2分)
②HPO32-+2H+=H3PO3(2分)
解析试题分析:(1)①根据盖斯定律可得Cu2S(s) + O2(g) =" 2Cu(s)" + SO2(g) △H=(①+②)/3=(-768.2kJ·mol-1+116.0kJ·mol-1)/3=-217.4KJ/mol;
②粗铜精炼时,粗铜作阳极,纯铜作阴极;
(2)①根据还原剂的判断,元素化合价升高的物质作还原剂,在4CuSO4 + 3H3PO2 + 6H2O =" 4CuH↓" + 4H2SO4 + 3H3PO4 中P元素的化合价升高,所以还原剂是H3PO2;
②该反应中每生成4molCuH转移 12mol电子,所以每转移3 mol电子,生成CuH的物质的量为1mol;
(3)①由图可知,当c(Cl-)="9" mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-);
②从图上可见,在c(Cl-)=1mol?L-1的氯化铜溶液中,主要是Cu2+与Cl-结合生成CuCl+,方程式为:Cu2++Cl-═CuCl+;
(4)①根据离子的放电顺序及溶液中离子的种类,在阳极放电的是氢氧根离子,所以阳极电极反应式为4OH--4e-=2H2O+O2↑;
②产品室中有亚磷酸生成,原料室中的磷酸氢根离子通过阴膜到达产品室,与通过阳膜到达产品室的氢离子结合生成亚磷酸,所以产品室中的离子方程式为HPO32-+2H+=H3PO3。
考点:考查盖斯定律的应用,氧化还原反应的计算,图像的分析,电解原理的应用

反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4==2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3==2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是
| A.两个反应中均为硫元素被氧化 |
| B.碘元素在反应①中被还原,在反应②中被氧化 |
| C.氧化性:MnO2>SO42->IO3->I2 |
| D.反应①、②中生成等量的I2时转移电子数比为1∶5 |
有Fe2+、NO-3、Fe3+、NH+4、H+和H2O六种微粒,分别属于同一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
| A.氧化剂与还原剂的物质的量之比为8:1 |
| B.还原产物为NH+4 |
| C.若有l mol NO-3参加还原反应,则转移8mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+—e-=Fe3+ |
(10分)为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示: ① 3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
② Na2FeO2+ NaNO2+ H2O → Na2Fe2O4+ NH3↑+ NaOH
③ Na2FeO2+Na2Fe2O4+2H2O Fe3O4+4NaOH
Fe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为 ,若有1mol Na2FeO2生成,则反应中有 mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是 。
| A.该生产过程不会产生污染 | B.反应③生成的四氧化三铁具有抗腐蚀作用 |
| C.反应①②③均是氧化还原反应 | D.反应①②中的氧化剂均为NaNO2 |
。
利用化合价和物质类别推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①将 通入酸性
通入酸性 溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是 。
溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是 。
| A.S2- | B.S | C.SO32- | D.SO42- |
请选取合适的试剂证明Na2SO3具有还原性, 并写出该反应的离子方程式为: .
(2)从物质分类的角度可以推测物质的性质。
①已知蛇纹石由MgO、Al2O3、SiO2、Fe2O3组成。其中属于碱性氧化物的是 。
②现取一份蛇纹石试样进行实验:
I.先将其溶于过量的盐酸中、过滤,滤渣的主要成分是 。
II.再向滤液中加入NaOH溶液至过量、过滤,滤渣中的主要成分是 。
 (1)Q单质的电子式为_______。
(1)Q单质的电子式为_______。
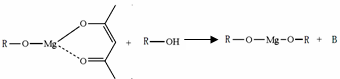
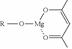 ,它可发生如下反应:
,它可发生如下反应: