题目内容
2.铜、锌两种元素的第一电离能、第二电离能如表所示:| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
分析 根据轨道中电子处于全满、全空、半满时较稳定,再失去电子需要的能量较大来分析.
解答 解:轨道中电子处于全满、全空、半满时较稳定,所以气态Cu失去一个电子变成结构为[Ar]3d10的Cu+,能量较低,所以Cu的第二电离能相对较大(或气态Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小),
故答案为:气态Cu失去一个电子变成结构为[Ar]3d10的Cu+,能量较低,所以Cu的第二电离能相对较大(或气态Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小).
点评 本题考查电离能大小的判断知识点,明确电离能大小与原子结构的关系是解本题关键,难度中等.

练习册系列答案
相关题目
17.有关苯的结构和性质,下列说法正确的是( )
| A. | 分子中含有碳碳双键 | |
| B. | 易被酸性KMnO4溶液氧化 | |
| C. | 与溴水发生加成反应而使溴水褪色 | |
| D. | 在一定条件下可与浓硝酸和浓硫酸的混合酸反应生成硝基苯 |
7.下列常用干燥剂,不能干燥氯气的是( )
| A. | 浓硫酸 | B. | 五氧二磷 | C. | 碱石灰 | D. | 氯化钙 |
14.(1)如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时放出(填吸收或放出)热量,△H小于(填大于或小于)0;
(2)对于反应2SO2+O2?2SO3 其它条件不变,只改变一个反应条件,将生成SO3的反应速率的变化填入表中空格里.(填字母 A.增大 B.减小 C.不变)
(2)对于反应2SO2+O2?2SO3 其它条件不变,只改变一个反应条件,将生成SO3的反应速率的变化填入表中空格里.(填字母 A.增大 B.减小 C.不变)
| 改变条件 | 速率变化 |
| 降低温度 | |
| 增大O2的浓度 | |
| 使用V2O5做催化剂 | |
| 压缩气体 |
11.下列说法错误的是( )
| A. | Al箔插入稀HNO3中,无现象,说明Al箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 工业上电解熔融状态的Al2O3制备Al | |
| C. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | |
| D. | 铝制容器可盛装浓H2SO4 |
20.TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料.实验室利用反应TiO2(s)+2CCl4(g)→TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下: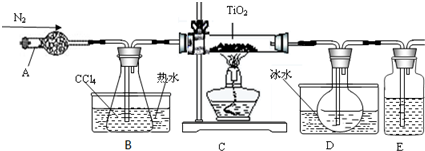
有关性质如下表
(1)仪器A的名称是干燥管,装置E中的试剂是浓硫酸.
(2)反应结束前依次进行如下操作:①停止通氮气 ②熄灭酒精灯 ③冷却至室温.正确的顺序为②③①(填序号).
(3)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(4)使用冰水混合物的目的是冷却TiCl4气体.
(5)TiCl4 遇到湿空气发生强烈的水解,其中一种物质是H2TiO3,试写出该水解反应方程式TiCl4+3H2O═H2TiO3↓+4HCl.
(6)实验室用含量为97%的TiO210克,用上述方法制备TiCl4,最终得到19.8克的产品,则TiO2的转化率为85.95%.

有关性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(2)反应结束前依次进行如下操作:①停止通氮气 ②熄灭酒精灯 ③冷却至室温.正确的顺序为②③①(填序号).
(3)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(4)使用冰水混合物的目的是冷却TiCl4气体.
(5)TiCl4 遇到湿空气发生强烈的水解,其中一种物质是H2TiO3,试写出该水解反应方程式TiCl4+3H2O═H2TiO3↓+4HCl.
(6)实验室用含量为97%的TiO210克,用上述方法制备TiCl4,最终得到19.8克的产品,则TiO2的转化率为85.95%.
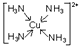 .已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:共用电子对偏向F而偏离N原子,使得N原子上的孤对电子难于与Cu2+形成配位键.
.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:共用电子对偏向F而偏离N原子,使得N原子上的孤对电子难于与Cu2+形成配位键.