题目内容
10.在100mLFeBr2溶液中通入标况下2.24LCl2,溶液溶液中有$\frac{1}{4}$的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为$\frac{4}{3}$mol/L.分析 由还原性Br-<Fe2+,液溶液中有$\frac{1}{4}$的Br-被氧化成单质Br2,则亚铁离子全部被氧化,结合电子守恒计算.
解答 解:n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,设原FeBr2溶液中FeBr2的物质的量浓度为x,
由还原性Br-<Fe2+,液溶液中有$\frac{1}{4}$的Br-被氧化成单质Br2,则亚铁离子全部被氧化,
由电子守恒可知,0.1L×x×(3-2)+0.1L×x×2×$\frac{1}{4}$×(1-0)=0.1mol×2×(1-0),
解得x=$\frac{4}{3}$ mol/L,
故答案为:$\frac{4}{3}$ mol/L.
点评 本题考查氧化还原反应的计算,为高频考点,把握优先氧化、电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案
相关题目
20.下列关于化学键的说法中正确的是( )
| A. | 单质分子中不一定存在共价键 | |
| B. | 离子化合物一定不含共价键 | |
| C. | 只由非金属元素组成的物质一定不含离子键 | |
| D. | 物质组成中含有金属元素的一定含有离子键 |
2.铜、锌两种元素的第一电离能、第二电离能如表所示:
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是气态Cu失去一个电子变成结构为[Ar]3d10的Cu+,能量较低,所以Cu的第二电离能相对较大(或气态Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小).
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
19.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 2.4g金属镁所含电子数目为0.2NA | |
| B. | 16g CH4所含原子数目为NA | |
| C. | 1mol氦气中有2NA个氦原子 | |
| D. | 2L 0.3mol•L-1 Na2SO4溶液中含1.2NA个Na+ |
8.硼镁泥是硼镁矿(主要成分:MgO•B2O3)生产硼砂(Na2B4O7)的废渣,生产原理如下:2MgO•B2O3+Na2CO3+CO2=Na2B4O7+2MgCO3.硼镁泥中的MgCO3是宝贵的镁资源.某研究小组以硼镁泥为原料提取MgSO4•7H2O,设计了如下流程图:

各离子开始沉淀和完全沉淀的pH值
请回答下列问题:
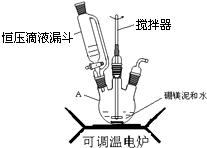
(1)步骤①可在如图装置中进行,仪器A的名称是三颈烧瓶;
(2)本实验中多次用到抽滤,相比普通过滤,抽滤的优点是速度快、得到的滤渣较干燥;
(3)步骤②中加硼镁泥的作用是消耗多余的硫酸使pH增加到5~6,促使Fe3+、Al3+完全沉淀,NaClO的作用是氧化Fe2+、Mn2+;
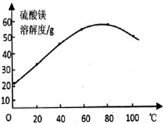
(4)步骤③趁热过滤的目的是防止析出MgSO4•7H2O该过程中温度应控制在80℃左右;
(5)步骤④的具体操作:当出现晶膜时即停止加热,其原因是防止MgSO4•7H2O失去结晶水.

各离子开始沉淀和完全沉淀的pH值
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀~沉淀完全的pH | 2.7~4.1 | 3.7~5.2 | 7.5~9.6 | 8.6~10.1 | 9.6~11.1 |

请回答下列问题:
(1)步骤①可在如图装置中进行,仪器A的名称是三颈烧瓶;

(2)本实验中多次用到抽滤,相比普通过滤,抽滤的优点是速度快、得到的滤渣较干燥;
(3)步骤②中加硼镁泥的作用是消耗多余的硫酸使pH增加到5~6,促使Fe3+、Al3+完全沉淀,NaClO的作用是氧化Fe2+、Mn2+;
(4)步骤③趁热过滤的目的是防止析出MgSO4•7H2O该过程中温度应控制在80℃左右;
(5)步骤④的具体操作:当出现晶膜时即停止加热,其原因是防止MgSO4•7H2O失去结晶水.

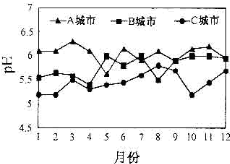 A、B、C三个城市全年雨水的月平均pH变化如图所示.
A、B、C三个城市全年雨水的月平均pH变化如图所示.