题目内容
【题目】钠及其化合物具有广泛的用途.
(1)工业上制备金属钠的常用方法是 . 试写出制备金属钠的化学方程式 . 金属钠可用于 (写出Na在熔点低方面的一种用途).
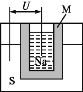
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池.该电池的结构如图所示:
①正极的电极反应式为 , 电池工作时物质A可循环使用,A物质的化学式为 .
②请写出检验Na2CO3中钠元素的方法 .
(3)常温下,浓度均为0.1molL﹣1的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaCO | NaCN |
pH | 8.8 | 9.7 | .6 | 0.3 | . |
上述盐溶液的阴离子中,结合H+能力最强的是 , 根据表中数据,浓度均为0.01molL﹣1的下列四种酸的溶液分别稀释100倍,pH变化最大的是(填序号).
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯.
①常温下,当300mL 1molL﹣1的NaOH溶液吸收4.48L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为 .
②已知几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时,(填离子符号)先沉淀,Ksp[Fe(OH)2] Ksp[Mg(OH)2](填“>”、“=”或“<”).
【答案】
(1)电解法;2NaCl(熔融) ![]() 2Na+Cl2↑;液态钠可作核反应堆的传热介质
2Na+Cl2↑;液态钠可作核反应堆的传热介质
(2)O2+4e﹣+2CO2=2CO32﹣;CO2;取一根洁净的铂丝蘸取碳酸钠粉末或碳酸钠溶液,放在酒精灯外焰上灼烧,观察火焰的颜色
(3)CO32﹣;c
(4)c(Na+)>c(HSO)>c(SO)>c(OH﹣)>c(H+);Cu2+;<
【解析】解:(1.)金属钠比较活泼,工业上通常通过电解熔融氯化钠获得金属钠,反应方程式为:2NaCl(熔融) ![]() 2Na+Cl2↑;由于金属钠的熔点较低,则液态钠可作核反应堆的传热介质,所以答案是:电解法;2NaCl(熔融)
2Na+Cl2↑;由于金属钠的熔点较低,则液态钠可作核反应堆的传热介质,所以答案是:电解法;2NaCl(熔融) ![]() 2Na+Cl2↑;液态钠可作核反应堆的传热介质;
2Na+Cl2↑;液态钠可作核反应堆的传热介质;
(2.)①该燃料电池的总反应为:2CO+O2=2CO2 , 通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为:O2+4e﹣+2CO2=2CO32﹣ , 通入CO的一极为原电池的负极,发生氧化反应,电极反应式为:2CO﹣4e﹣+2CO32﹣=4CO2 , 由电极反应可知电池工作时参加循环的物质为CO2 , 所以答案是:O2+4e﹣+2CO2=2CO32﹣;CO2;
②可通过焰色反应检验Na2CO3中钠元素,操作方法为:取一根洁净的铂丝蘸取碳酸钠粉末或碳酸钠溶液,放在酒精灯外焰上灼烧,观察火焰的颜色为黄色,所以答案是:取一根洁净的铂丝蘸取碳酸钠粉末或碳酸钠溶液,放在酒精灯外焰上灼烧,观察火焰的颜色;
(3.)越容易水解的盐,越容易结合氢离子,相同浓度的钠盐溶液,pH越大则盐的水解程度越大,所以最易水解的盐是碳酸钠,所以最容易结合氢离子的阴离子是CO32﹣;浓度相同的酸稀释相同的倍数后,酸性越强的酸其pH变化越大,HCN、HClO、CH3COOH、H2CO3四种酸的酸性大小顺序是CH3COOH>H2CO3>HClO>HCN,所以溶液的pH变化最大的是醋酸,故选c;所以答案是:CO32﹣;c;
(4.)①300mL 1molL﹣1的NaOH的物质的量=1mol/L×0.3L=0.3mol,标准状况下4.48LSO2的物质的量= ![]() =0.2mol,所以氢氧化钠和二氧化硫反应方程式为2SO2+3NaOH=Na2SO3+NaHSO3+H2O,溶液中硫酸根离子水解而使溶液呈碱性,即c(OH﹣)>c(H+),硫酸根离子水解生成硫酸氢根离子,所以c(HSO3﹣)>c(SO32﹣),由于水解程度较小,所以c(SO32﹣)>c(OH﹣),故溶液中各离子浓度大小顺序是:c(Na+)>c(HSO)>c(SO)>c(OH﹣)>c(H+),所以答案是:c(Na+)>c(HSO)>c(SO)>c(OH﹣)>c(H+);②pH小的离子先沉淀,溶度积常数越小的物质越先沉淀,所以Cu2+先沉淀,KSP[(Fe(OH)2]<KSP[(Mg(OH)2],所以答案是:Cu2+;<.
=0.2mol,所以氢氧化钠和二氧化硫反应方程式为2SO2+3NaOH=Na2SO3+NaHSO3+H2O,溶液中硫酸根离子水解而使溶液呈碱性,即c(OH﹣)>c(H+),硫酸根离子水解生成硫酸氢根离子,所以c(HSO3﹣)>c(SO32﹣),由于水解程度较小,所以c(SO32﹣)>c(OH﹣),故溶液中各离子浓度大小顺序是:c(Na+)>c(HSO)>c(SO)>c(OH﹣)>c(H+),所以答案是:c(Na+)>c(HSO)>c(SO)>c(OH﹣)>c(H+);②pH小的离子先沉淀,溶度积常数越小的物质越先沉淀,所以Cu2+先沉淀,KSP[(Fe(OH)2]<KSP[(Mg(OH)2],所以答案是:Cu2+;<.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

【题目】温度为T时,向4L恒容密闭容器中充入2molPCl5,反应PCl5(g)PCl3(g)+Cl2(g),经一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
A.反应在前50s的平均速率为v(PCl3)=0.0064mol/(Ls)
B.保持其它条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则反应的△H<0
C.相同温度下,起始时向容器中充入4molPCl3、4molCl2 , 达到平衡时,则此反应的化学平衡常数为0.025mol/L
D.相同温度下,起始时间向容器中充入2molPCl5、0.40molPCl3和0.40molCl2 , 达到平衡前v(正)<v(逆)