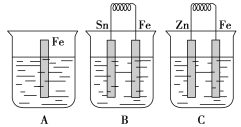
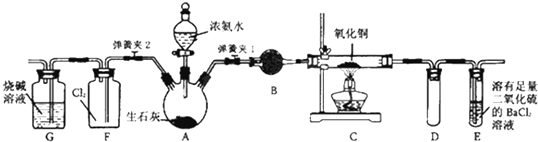
��Ŀ����
����Ŀ���¶�ΪTʱ����4L�����ܱ������г���2molPCl5����ӦPCl5��g��PCl3��g��+Cl2��g������һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ���ǣ� ��
t/s | 0 | 50 | 150 | 250 | 350 |
n��PCl3��/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
A.��Ӧ��ǰ50s��ƽ������Ϊv��PCl3��=0.0064mol/��Ls��
B.���������������䣬�����¶ȣ�ƽ��ʱc��PCl3��=0.11mol/L����Ӧ�ġ�H��0
C.��ͬ�¶��£���ʼʱ�������г���4molPCl3��4molCl2 �� �ﵽƽ��ʱ����˷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ0.025mol/L
D.��ͬ�¶��£���ʼʱ���������г���2molPCl5��0.40molPCl3��0.40molCl2 �� �ﵽƽ��ǰv��������v���棩
���𰸡�C
���������⣺A����Ӧ��ǰ50 s��ƽ������Ϊv��PCl3��= ![]() =0.0016 molL��1s��1 �� ��A����
=0.0016 molL��1s��1 �� ��A����
B�������¶ȣ�ƽ��ʱ��c��PCl3��=0.11 molL��1 �� ����ͼ����PCl3Ũ��= ![]() =0.1mol/L��˵������ƽ��������У�����ӦΪ���ȷ�Ӧ����H��0����B����
=0.1mol/L��˵������ƽ��������У�����ӦΪ���ȷ�Ӧ����H��0����B����
C��ƽ���PCl3���ʵ���Ϊ0.4mol��
PCl5��g�� | PCl3��g�� | + | Cl2��g�� | ||
��ʼ����mol/L�� | 0.5 | 0 | 0 | ||
�仯����mol/L�� | 0.1 | 0.1 | 0.1 | ||
ƽ������mol/L�� | 0.4 | 0.1 | 0.1 |
ƽ�ⳣ��K= ![]() =0.025����C��ȷ��
=0.025����C��ȷ��
D����ͬ�¶��£���ʼʱ�������г���2.0molPCl5��0.40molPCl3��0.40molCl2 �� ����Ũ�ȷֱ�Ϊ0.5mol/L��0.1mol/L��0.1mol/L�����Ũ����Q= ![]() =0.02��K=0.025����Ӧû�дﵽƽ��״̬����Ӧ������У��ﵽƽ��ǰv��������v���棩����D����
=0.02��K=0.025����Ӧû�дﵽƽ��״̬����Ӧ������У��ﵽƽ��ǰv��������v���棩����D����
��ѡC��
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���ʼ����������֪ʶ�����ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч�����Լ��Ի�ѧƽ��ļ�������⣬�˽ⷴӦ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���Ƽ��仯������й㷺����;��
��1����ҵ���Ʊ������Ƶij��÷����� �� ��д���Ʊ������ƵĻ�ѧ����ʽ �� �����ƿ����� ��д��Na���۵�ͷ����һ����;����
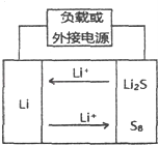
��2����Na2CO3������������ʣ�CO��O2��CO2Ϊԭ�Ͽ�������͵�أ��õ�صĽṹ��ͼ��ʾ��
�������ĵ缫��ӦʽΪ �� ��ع���ʱ����A��ѭ��ʹ�ã�A���ʵĻ�ѧʽΪ ��
����д������Na2CO3����Ԫ�صķ��� ��
��3�������£�Ũ�Ⱦ�Ϊ0.1molL��1����������������Һ��pH���±���
���� | CH3COONa | NaHCO3 | Na2CO3 | NaCO | NaCN |
pH | 8.8 | 9.7 | .6 | 0.3 | �� |
��������Һ���������У����H+������ǿ���� �� ���ݱ������ݣ�Ũ�Ⱦ�Ϊ0.01molL��1���������������Һ�ֱ�ϡ��100����pH�仯������������ţ���
a��HCN b��HClO c��CH3COOH d��H2CO3
��4��ʵ�����г���NaOH������β��������ϴ�����ᴿ��
�ٳ����£���300mL 1molL��1��NaOH��Һ����4.48L������ɱ�״����SO2ʱ��������ҺpH��7������Һ�и�����Ũ���ɴ�С��˳��Ϊ ��
����֪�������ӿ�ʼ����ʱ��pH���±���
���� | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
������ͬŨ��Cu2+��Mg2+��Fe2+����Һ�еμ�ijŨ�ȵ�NaOH��Һʱ���������ӷ��ţ��ȳ�����Ksp[Fe��OH��2] Ksp[Mg��OH��2]�����������=����������