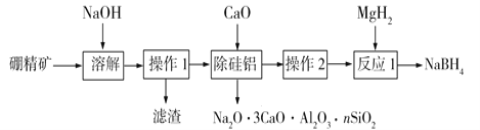
题目内容
【题目】Ba(OH)2 是一种强碱,可用于测定天然气中 CO2 的含量。
(1)CO2 的密度比空气______(填“大”或“小”)
(2)①称取5.25g 试样[含有 Ba(OH)2xH2O 和杂质]配成 100 mL 溶液,配制溶液中用到的仪器有天平、药匙、量筒、烧杯、玻璃棒、______、胶头滴管。用 15.00 mL 0.2 mol/L盐酸与上述 Ba(OH)2 溶液反应,消耗该 Ba(OH)2溶液 10.00 mL(杂质不与酸反应)
②另取5.25 g 试样加热至失去全部结晶水(杂质不分解),称得剩余固体质量为3.09 g, 求 Ba(OH)2xH2O中的 x=______________。
【答案】大 100mL 容量瓶 8
【解析】
(1)空气的平均摩尔质量为29g/mol,二氧化碳的相对分子质量是44 CO2,相同条件下,气体摩尔质量越大,密度越大,则CO2密度比空气大。
故答案为:大;
(2)配制100 mL 溶液用到的仪器有天平、药匙、量筒、烧杯、玻璃棒、100 mL容量瓶、胶头滴管。
①15.0mL0.200mol·L1盐酸溶液中HCl的物质的量为0.015L×0.2mol/L=0.003mol,
设取出的10mL溶液中氢氧化钡的物质的量为n,则:
Ba(OH)2+2HCl═BaCl2+2H2O,
1mol 2mol
n 0.003mol
故n =0.0015mol
②则5.25g试样含有Ba(OH)2的物质的量为![]() =0.015mol,
=0.015mol,
含有水的物质的量为![]() =0.12mol,
=0.12mol,
所以1: x =0.015mol:0.12mol,解得x=8,
答案为:8。

 阅读快车系列答案
阅读快车系列答案【题目】依据所给条件推出的结论不正确的是( )
选项 | 条件 | 结论 |
A | 在水溶液或熔融状态下可以导电的化合物,称为电解质 | 水中存在: |
B | 凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱 |
|
C | 联氨为二元弱碱,在水中的电离方式与氨相似 | 联氨与硫酸形成的酸式盐的化学式为: |
D | 发生化学反应时,接受电子对的物质为酸,提供电子对的物质为碱 |
|
A. AB. BC. CD. D